
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据________________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理__________________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)A的组成元素为_____________(用元素符号表示),化学式为__________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式______________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是_________,属于非电解质的是______________。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用双线桥标出电子转移的方向和数目;
②被氧化与未被氧化的H2SO4的物质的量之比为___________,当电子转移0.1mol时,消耗还原剂的质量为_______________。
(4)如图1表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是___________,这样操作所配制的溶液比要求的浓度要___________ (填“偏高”、“偏低”、“不影响”)。配制应称取___________gNaOH。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 molA气体和2 molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) ![]() 2C(g),若经2s(秒)后测得C的浓度为0.6 mol.L-1现有下列几种说法:
2C(g),若经2s(秒)后测得C的浓度为0.6 mol.L-1现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol.L-1.S-1
②用物质B表示的反应的平均速率为0.6mol.L-1.S-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol.L-1
其中正确的是 ( )
A.①③ B.①④ C、②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是

A. 电极a为电池的正极
B. 电极b上发生的电极反应为:O2+2H2O+4e![]() =" 4" OH
=" 4" OH![]()
C. 电路中每流过4mol电子,电池内部释放632kJ热能
D. 每17gH2S参与反应,有1mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,可以加快反应速率的是( )
A.钠与水反应时,增加水的量
B.锌与稀硫酸反应时,加入少量CuSO4固体
C.用18mol/L的硫酸溶液代替2mol/L硫酸溶液常温下与铝反应
D.锌与稀硫酸反应时,加入少量醋酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展“绿色食品”是提高人类生存质量的重要措施,绿色食品指( )
A.绿颜色的营养食品 B.含叶绿素的营养食品
C.植物类营养食品 D.安全无公害的营养食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
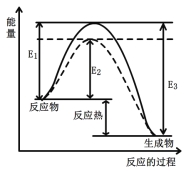

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 _______(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 _____(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。请回答下列问题。

(1)铜和浓硫酸反应中浓硫酸的作用为______________。
(2)B 瓶中盛有品红溶液,观察到品红溶液褪色,这是因为SO2具有_______,C 瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有_________。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,该反应的主要产物的化学式为________。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入____________
A .HNO3 B .NaNO3 C.NaHCO3 D.Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com