
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小 B. BaO量不变
C. 氧气压强变大 D. BaO2量增加
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸钴用作催化剂及制钴盐原料,陶瓷工业着色剂,电子、磁性材料的添加剂。利用以下装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成。

已知:碱式碳酸钴中钴为+2价,受热时可分解生成三种氧化物。请回答下列问题:
(1)选用以上装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成,其正确的连接顺序为a→b→____(按气流方向,用小写字母表示)。
(2)样品分解完,打开活塞K,缓缓通入氮气数分钟,通入氮气的目的是_______________。
(3)取碱式碳酸钴样品34.9 g,通过实验测得分解生成的水和二氧化碳的质量分别为3.6 g、8.8 g,则该碱式碳酸钴的化学式为______________________________。
(4)某兴趣小组以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种实验设计流程如下:

已知:25 ℃时,部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 1.9 | 7.0 | 7.6 | 3.4 |
完全沉淀(pH) | 3.2 | 9.0 | 9.2 | 4.7 |
①操作Ⅰ用到的玻璃仪器主要有___________、_____________、___________;
②加盐酸调整pH为2~3的目的为____________________________________________;
③操作Ⅱ的过程为_______________、_______________、____________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e- =2CO32-+12H2O,7H2O+![]() O2+14e- =14OH-,有关此电池的推断正确的是
O2+14e- =14OH-,有关此电池的推断正确的是
A. 电解质溶液中电子向正极移动
B. 放电一段时间后,KOH的物质的量浓度不变
C. 通乙烷的电极为负极
D. 参加反应的O2和C2H6的物质的量之比为2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛的应用。

上图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为________,在X极附近观察到的现象是__________________________ 。电解液中向X极方向移动的离子是______。
②检验Y电极反应产物的方法是________________
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________
②溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电解池盛放的电镀液必须含有浓度较高的________(要求填电解质溶液中所含的阳离子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,下列所表示的化学反应速率中最大的是
2AB3(g)反应来说,下列所表示的化学反应速率中最大的是
A. v(A2)=0.8mol·L-1·s-1 B. v(A2)=40mol·L-1·min-1
C. v(AB3)=1.0mol·L-1·s-1 D. v(B2)=1.2mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是某些姜科植物根茎的提取物,具有抗肿瘤、抗菌、抗氧化等功效,其一种合成路线如下:

已知:i 质谱图显示有机物D的最大质荷比为94,且D遇FeCl3溶液显紫色
ii RMgBr+R′CHO→![]()
回答下列问题:
(1)D的化学式为___________;B的名称为___________。
(2)反应①的反应类型是___________:I中所含官能团的名称为___________。
(3)反应④的化学方程式是______________________。
(4)X是H的同系物,其相对分子质量比H小14,则X的同分异构体中,符合下列条件的有___________种(不含立体异构)
a.属于芳香族化合物 b.能发生水解反应 c.能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的结构简式是___________(写一种即可)。
(5)补充完成由甲苯和丙醛为原料,制备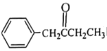 的合成路线(无机试剂任选)
的合成路线(无机试剂任选) ____________
____________ 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,36g18O2中所含的中子数为16NA
B. 8.0 g Cu2S和CuO的混合物中含有的铜原子数为0.1NA
C. 电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2NA
D. 室温下向1LpH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧白铁皮(含Fe、Zn、Fe2O3、ZnO)制备磁性Fe3O4胶体流程及制备装置如下:


已知:锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。
请回答:
(1)下列说法不正确的是____。
A.步骤I碱溶的目的是去除油污,溶解镀锌层
B.步骤II为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
C.步骤III可通过测定pH验证水洗是否干净
D.步骤IV可用右图操作加快酸溶速率
(2)“部分氧化”阶段,ClO3-被还原为Cl-,该反应的离子方程式是____。
(3)经测定溶液B中Fe2+、Fe3+的物质的量之比是1:2。检验其中Fe3+可选用的试剂是____。
A.NaOH溶液 B.KSCN溶液
C.KMnO4溶液 D.K4[Fe(CN)6]溶液
(4)步骤VI制备Fe3O4胶体装置如图所示:

①持续通入N2的原因是____。
②滴液漏斗中应装____。(填“NaOH溶液”或“溶液B”)
(5)Fe3O4胶体粒子不能采用抽滤法实现固液分离,理由是____。
(6)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。
①若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液240 mL,应准确称取____g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
②滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,则滴定结果____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com