
【题目】在配制溶液过程中正确的是( )
A. 配制盐酸溶液用量筒量取盐酸时量筒必须先润洗
B. 配制盐酸溶液时,容量瓶中少量的水不影响最终的浓度
C. 定容时观察液面俯视会造成所配溶液浓度偏低
D. 浓H2SO4稀释后即可注入容量瓶配制
科目:高中化学 来源: 题型:
【题目】已知X、Y均为主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的( )
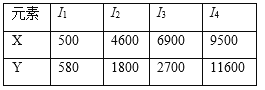
A. 元素X的常见化合价是+1价
B. 元素Y是ⅢA族的元素
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列有关物质的用途和原理分析正确的是
选项 | 物质的用途 | 原理和分析 |
A | 漂白粉可用于食品漂白 | 漂白粉能使食品中的色素褪色 |
B | Al(OH)3可中和胃酸 | Al(OH)3能与胃液中的酸发生中和反应 |
C | Na2O2常作供氧剂 | Na2O2在常温下能分解放出O2 |
D | 明矾可作净水剂 | 明矾溶于水后能消毒杀菌 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
①碳酸钙和盐酸(写出离子方程式)____________________________________。
②氢氧化钡溶液和硫酸铜溶液(写出离子方程式)________________________。
③Fe2(SO4)3(写出电离方程式)_________________________________________。
④H++OH-![]() H2O(写出对应的化学方程式)_______________________________。
H2O(写出对应的化学方程式)_______________________________。
⑤制取氢氧化铁胶体(写出对应的化学方程式) ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )

A. X使蔗糖变黑的现象主要体现了X的脱水性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水中,一定有白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A. 酸性氧化物:CO2、SiO2、SO2、NO2
B. 碱:NaOH、KOH、Ba(OH)2、纯碱
C. 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体
D. 碱性氧化物:Na2O2、CaO、MgO、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 10℃时,将100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,再冷却到10℃时,其体积小于100 mL,但其物质的量浓度仍为0.35 mol·L-1
B. 将10 mL 1 mol·L-1的H2SO4稀释成0.1 mol·L-1的H2SO4,可向其中加入100 mL水
C. 在K2SO4和NaCl的混合水溶液中,如果Na+和SO![]() 的物质的量浓度相等,则K+和Cl-的物质的量浓度也一定相同
的物质的量浓度相等,则K+和Cl-的物质的量浓度也一定相同
D. 50 g浓度为c mol·L-1,密度为ρ g·cm-3的氨水(ρ<1)中加入一定量的水(密度为1 g·cm-3)稀释成0.5c mol·L-1,则加入水的体积应小于50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)—定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g) +NaCl(s) | K1 |
② | 4NO2(g) +2NaCl(s) | k2 |
③ | 2NO(g)+Cl2(g) | K3 |
K3=_______(用K1、K2表示)。
(2)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H3。
2ClNO(g) △H3。
① 下列描述能说明该反应已达到平衡状态的是_____(填序号)
a.v正(Cl2)=2v逆(NO) b.容器内混合气体的密度保持不变
c.容器内气体压强保持不变 d.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(P)随时间(t)的变化如图I曲线a所示,则△H3______0(填“ >”、“ < ”或“不确定");若其他条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I曲线b所示,則改变的条件是_________。
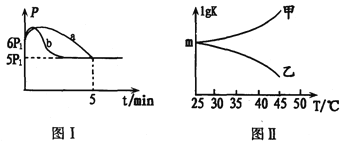
③图II是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com