
【题目】下列有机物命名正确的是
A. 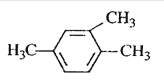 1,3,4-三甲苯
1,3,4-三甲苯
B. 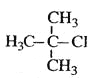 2-甲基-2-氯丙烷
2-甲基-2-氯丙烷
C. 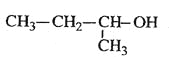 2-甲基-1-丙醇
2-甲基-1-丙醇
D. 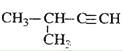 2-甲基-3-丁炔
2-甲基-3-丁炔
【答案】B
【解析】
试题烷烃的命名原则是:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙...)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷;从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。以数字代表取代基的位置。数字与中文数字之间以- 隔开;有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙基、丙基的顺序列出所有取代基;有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以 , 隔开,一起列于取代基前面。如果含有官能团,则含有官能团的最长碳链作主链,编号也是从离官能团最近的一端开始,据此可知,B正确。A不正确,应该是1,2,4-三甲苯;C不正确,应该是2-丁醇;D不正确,应该是3-甲基-1-丁炔,答案选B。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有一固体粉末,可能由Na2CO3、Na2SO4、CuSO4、NH4Cl中的一种或几种组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加氯化钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀盐酸中,发现沉淀不溶解。
(1)试判断:固体混合物中肯定含有____________________,生成白色沉淀的化学方程式______________________________________;肯定没有_____________________________;可能含有________________________
(2)检验是否含有可能存在的物质的实验方法是:________化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
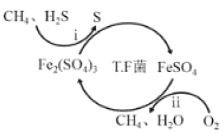
过程i的离子反应方程式为_____。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在表中选择最佳pH范围是____<pH<____,这样选择的原因是:______。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
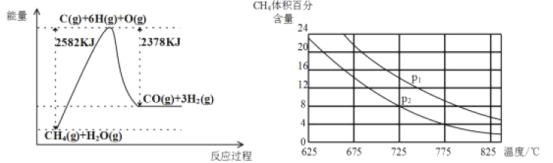
(3)①该过程的热化学方程式是_____。
②比较压强P1和P2的大小关系:P1____P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
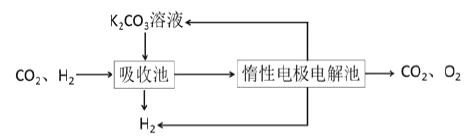
(4)吸收池中发生反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质试自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____,D在周期表中的位置______.E的离子结构示意图___.
(2)B2分子的电子式:__,A2C的结构式:______.
(3)用电子式表示D2E化合物的形成过程为__.
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______.
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是____(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫酸镍溶于过量的氨水可形成[Ni(NH3)6]SO4溶液。
①[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_____,中心原子(离子)是____;
②SO42-中,中心原子的轨道杂化类型为_______;
③写出一种与SO42-互为等电子体的分子的化学式______;
(2)NH3极易溶于水,除因为它们都是极性分子外,还因为__________。
(3)已知H—H键能为436kJ/mol,N≡N键的键能为945kJ/mol,根据化学方程式:N2+3H2 ==2NH3 ΔH=-92.4kJ/mol,则H—N键能为____kJ/mol。
(4)下列分子既存在p-sp σ键,也存在p-p π键的是_____。
A.NH3 B.H2 C.CO2 D.C2H2
(5)根据已经掌握的共价键知识判断,键的极性N—H___O—H(“>”,“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L己烷中含有碳原子的数目为6NA
B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:
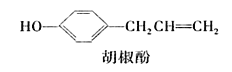
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1 mol该化合物最多可与2 mol Br2发生反应。其中正确的是( )
A. ①③B. ①②④C. ②③D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
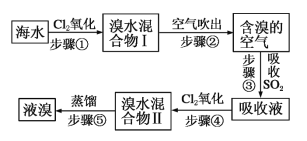
(1)步骤①反应的离子方程式是___________________。
(2)步骤③反应的化学方程式是___________________,从理论上考虑,下列也能吸收Br2的是___________________。
A.FeCl2 B.Na2SO3 C.H2O
(3)步骤①中已获得Br2,步骤③中又将Br2还原为Br-,步骤④又生成Br2,这样做的目的为___________________。
(4)已知海水中Br-含量为64mg/L,依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为___________________L(忽略Cl2的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
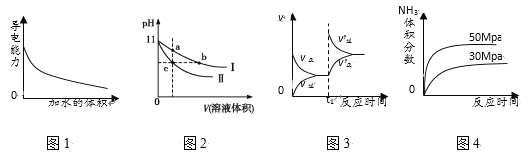
A. 图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化
B. 图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=b<a
C. 图3表示t1时刻改变的条件为升高温度,平衡向逆反应方向移动
D. 图4表示一定条件下,合成氨反应中压强对氨气体积分数的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com