
【题目】下列图示与对应的叙述相符的是( )
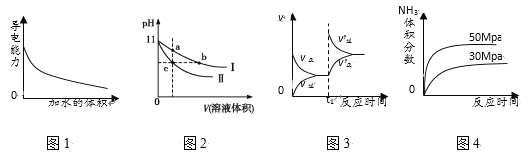
A. 图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化
B. 图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=b<a
C. 图3表示t1时刻改变的条件为升高温度,平衡向逆反应方向移动
D. 图4表示一定条件下,合成氨反应中压强对氨气体积分数的影响
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )
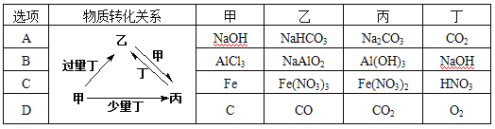
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:

已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是___________________。
(4) Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有__________,请写出工业上用氯气和消石灰生产漂粉精的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是 Zn 和 Cu 形成的原电池,其实兴趣小组做完实验后,在读书卡片上记下结论。其中正确的一组是( )
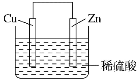
①Zn 为正极,Cu 为负极 ②H+向负极移动 ③电子是由 Zn 经外电路流向 Cu ④Cu 极上有 H2 产生 ⑤若有 1 mol 电子流过导线,则产生的 H2 为 0.5 mol ⑥正极的电极反应式为 Zn-2e-=Zn2+
A.①②③B.④⑤⑥
C.③④⑤D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.1 mo1.L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是

A. M点溶液中水的电离程度比原溶液大
B. 随着NaOH的加入,NH4+与NH3·H2O物质的量总量减少
C. 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+)
D. 在M点时,n(OH-)+0.05=a+n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_______;正极的电极反应式为____________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,则负极的电极反应式为_____________________;
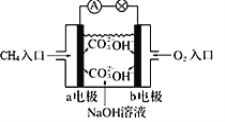
②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 +Pb+2H2SO4=2PbSO4 + 2H2O,铅蓄电池负极的电极反应式为_____;充电时,铅蓄电池的PbO2极应与外加直流电源的____极相连。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应物质)时,以硫酸铜溶液为电解质溶液,粗铜做____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.0.5molO3的质量为16.0g
B.2molH2SO4的摩尔质量为196gmol-1
C.NO的摩尔质量与相对分子质量相等
D.40gNaOH溶于水配成1L溶液,则c(NaOH)=1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。
(1)基态钛原子核外共有_______种运动状态不相同的电子,价电子排布式_______;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_________。
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是_______;TiCl4稳定性比CCl4差,试从结构分析其原因:_______。
(4)钙钛矿材料是一类有着与钛酸钙相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。钛酸钙晶体结构如图所示。其中,A代表Ca2+,Ti原子位于由O原子构成的正八面体的中心,则钛酸钙的化学式为______,Ca2+的配位数是________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com