
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。
(1)基态钛原子核外共有_______种运动状态不相同的电子,价电子排布式_______;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_________。
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是_______;TiCl4稳定性比CCl4差,试从结构分析其原因:_______。
(4)钙钛矿材料是一类有着与钛酸钙相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。钛酸钙晶体结构如图所示。其中,A代表Ca2+,Ti原子位于由O原子构成的正八面体的中心,则钛酸钙的化学式为______,Ca2+的配位数是________。

【答案】22 3d24s2 3 钛原子的价电子数比Al多,金属键更强 正四面体 钛原子半径比碳大,Ti-Cl键比C-Cl键的键长大、键能小,易断裂 CaTiO3 12
【解析】
(1)原子核外有多少电子,电子的运动状态就有多少;根据构造原理先写出Ti的核外电子排布式,就可得到其价层电子排布式;然后根据每个能级具有的轨道数判断与Ti具有相同未成对电子数目;
(2)钛、铝都属于金属晶体,金属键越强,金属晶体的硬度越大;
(3)根据物质的熔沸点与晶体类型关系分析;利用价层电子对数判断分子空间构型;根据共价键的牢固程度判断物质的稳定性大小;
(4)钙钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊法计算图中立方体中各原子数目确定化学式。
(1)由于在任何一个原子中都不存在运动状态完全相同的电子,所以22号Ti元素的原子核外有22种运动状态不相同的电子,Ti的核外电子排布式为1s22s22p63s23p63d24s2,可见其价层电子排布式为3d24s2;在Ti原子核外有2个未成对电子,同周期中未成对电子数与钛相同的元素原子价电子排布式为3d84s2、4s24p2、4s24p4,因此有3种;
(2)钛、铝都属于金属晶体,金属键影响硬度,钛的价电子比Al的多,金属键比Al的强,所以钛的硬度大于铝;
(3)在TiCl4分子中Ti原子价层电子对水为4,没有孤对电子,因此分子的空间构型是正四面体,TiCl4与CCl4都是分子晶体,但TiCl4稳定性比CCl4差,是因为钛原子半径比碳大,Ti-Cl键比C-Cl键的键长大、键能小,易断裂;
(4)由于A代表Ca2+,Ti原子位于由O原子构成的正八面体的中心,根据图示可知钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×![]() =3,所以晶胞的化学式为CaTiO3。
=3,所以晶胞的化学式为CaTiO3。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
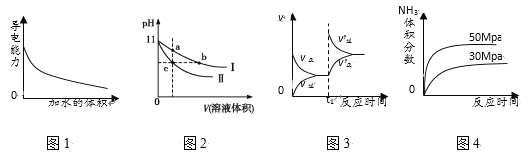
A. 图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化
B. 图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=b<a
C. 图3表示t1时刻改变的条件为升高温度,平衡向逆反应方向移动
D. 图4表示一定条件下,合成氨反应中压强对氨气体积分数的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,常温下B、D为气态化合物,C为液态化合物,图中有部分生成物未标出。已知﹕2Mg+CO2![]() 2MgO+C。
2MgO+C。
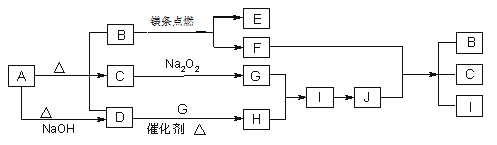
请回答下列问题:
(1)写出A的化学式:___。
(2)写出下列反应的化学方程式:
D+G→H___。
F+J→B+C+I___。
(3)写出A+NaOH→D的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料的碳一化学处于未来化学产业的核心,成为科学家研究的重要课题。
(1))已知CO、H2、CH3OH(g)的燃烧热分别为-283.0 kJ·mol-1、-285.8 kJ·mol-1、-764.5 kJ·mol-1。则反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH=_____;。
CH3OH(g) ΔH=_____;。
(2)在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。
CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2时,经过5 min达到平衡,CO的转化率为0.6,则0~5 min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4 mol,达到新平衡时H2的转化率将____(填“增大”“减小”或“不变”)。
②当n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为________。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_____L。
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的负极为__(填“A”或“B”),写出阳极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力增强
B.铁在潮湿的环境下生锈以及Mg与NH4Cl溶液反应生成H2都与盐类水解有关
C.将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3
D.将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+
Fe(OH)3(胶体) +3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较下列粒子的半径大小
①Na Mg O F __________
②Na+ Mg2+ O2- F-__________
③Fe Fe2+ Fe3+__________
④Na+ Mg2+ S2- Cl-__________
(2)下列物质中:只存在共价键的是__________(填序号,下同),只存在离子键的是__________,既存在离子键又存在极性共价键的是__________,既存在离子键又存在非极性共价键的是__________。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ===CO2(g)+4H2(g) 反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如代数式表示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |

则根据该反应制取1mol H2要吸收或放出热量为___________kJ(用含a、b、c、d字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
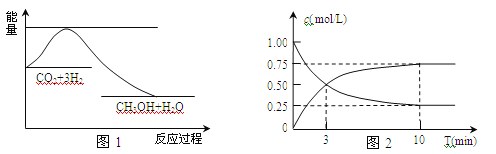
(1)关于该反应的下列说法中,正确的是_________(填字母)。
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,H2的平均反应速率v(H2)=________;CO2的转化率w(CO2)=________。
②该反应的平衡常数K=_____________。(只列表达式和计算式,不必计算出结果)
③下列措施中能使化学平衡向正反应方向移动的是________________(填字母)。
A.将CH3OH(g)及时液化抽出 B.升高温度
C.选择高效催化剂 D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16 g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式:______________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E(g)和F(g)加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)G(g),已知该反应的平衡常数如表所示。下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数/(L3·mol-3) | 5×104 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.25 ℃时,反应G(g)E(s)+4F(g)的平衡常数是0.5 mol3·L-3
C.在80 ℃时,测得某时刻,F、G的浓度均为0.5 mol·L-1,则此时v正>v逆
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气,下列关于Na2O2的叙述正确的是( )
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
④Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑤Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
A.①③⑤B.②③⑤C.①②⑤D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com