
【题目】目前,世界上已合成了几百种有机超导体,TCNQ是其中之一。TCNQ的分子结构如下图所示.下列关于TCNQ说法错误的是 ( )
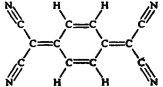
A. 分子中所有的氮原子可能在同一平面内
B. 属于芳香烃
C. 分子式为C12H4N4
D. 该物质难溶于水
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某研究小组用下图所示的实验装置,利用氢氧化钠固体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理:2NH3(g) + CO2(g)=H2NCOONH4(s) ΔH<0。
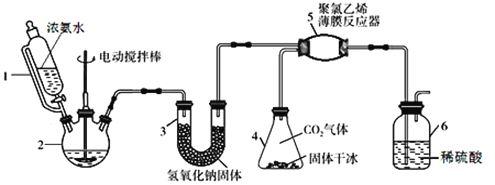
(1)实验室用98%的浓硫酸配制15%的稀硫酸,除量筒外还需使用下列仪器中的____。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)仪器1恒压分液漏斗,其优点是__________________________。
(3)仪器3中NaOH固体的作用是__________________________。
(4)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(5)另有一种制备氨基甲酸铵的反应器(CCl4与液体石蜡均为惰性介质)如图。生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。
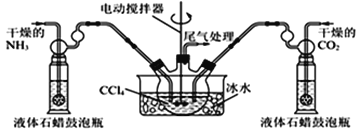
①发生器用冰水冷却的原因是________________________________________;
②从反应后混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_____(填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(6)已知氨基甲酸铵可完全水解,其中产物有碳酸氢铵。氨基甲酸铵水解反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、W在周期表中的位置如图:
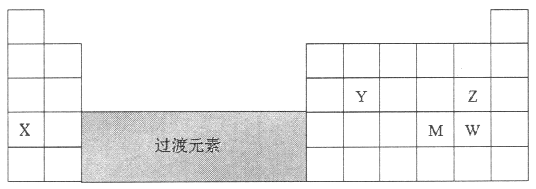
(1)X的元素符号是_________。
(2)YO2是玻璃的成分之一,是酸性氧化物。实验室盛装NaOH溶液的试剂瓶不能用玻璃塞的原因是:_________+_________OH-=_________+_________。
(3)元素Z和元素W中,非金属性比较弱的是_________(填元素符号)。在Z和W形成的原子个数比为1:1的化合物中,W的化合价是_________。
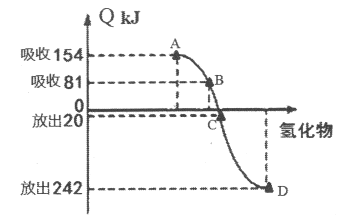
(4)元素M(Se)是人体必需的微量元素。Se能与H2反应生成H2Se,用原子结构解释原因_________。298K、1.01×105pa时,O2、S、Se、Te分别与H2化合生成1 mol气态氢化物时的热量的变化数据(Q)如下图所示。图中表示Se与H2化合的点是_________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医药合成中可用下列流程合成一种治疗心脏病的特效药物(G)。

已知:①RCH=CH2![]() RCH2CH2CHO;
RCH2CH2CHO;
②
(1)B的核磁共振氢谱图中有_______组吸收峰,C的名称为_________。
(2)E中含氧官能团的名称为_______,写出D→E的化学方程式_______ 。
(3)E-F的反应类型为________ 。
(4)E的同分异构体中,结构中有醚键且苯环上只有一个取代基结构有_____种,写出其中甲基数目最多的同分异构体的结构简式_______ 。
(5)下列有关产物G的说法正确的是__________
A.G的分子式为C15H28O2 B.1molG水解能消耗2molNaOH
C.G中至少有8个C原子共平面 D.合成路线中生成G的反应为取代反应
(6)写出以1-丁醇为原料制备C的同分异构体正戊酸(CH3CH2CH2CH2COOH)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH,无机试剂任选。___________
CH3CH2OH,无机试剂任选。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=c(FeO)c(CO)/c(Fe)c(CO2)
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A. 混合酸中NO3-物质的量为0.4mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学电源的叙述中正确的是
A. 比火力发电对化学能的利用率高
B. 所提供的电能居于人类社会现阶段总耗电量的首位
C. 都是安全、无污染的
D. 都为可充电电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,前者小于后者的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)═2H2O(l) ΔH1
H2(g)+![]() O2(g)===H2O(l) ΔH2
O2(g)===H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时分别反应放出的热量
④CaCO3(s)===CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A. ①②③ B. ②④ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)ΔH=-444.3kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是
A.焓变B.温度
C.压强D.熵变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com