
【题目】元素X、Y、Z、M、W在周期表中的位置如图:
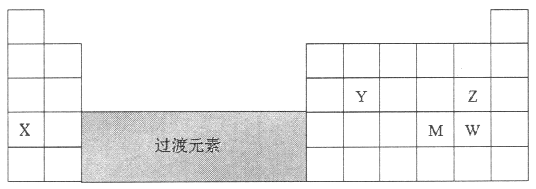
(1)X的元素符号是_________。
(2)YO2是玻璃的成分之一,是酸性氧化物。实验室盛装NaOH溶液的试剂瓶不能用玻璃塞的原因是:_________+_________OH-=_________+_________。
(3)元素Z和元素W中,非金属性比较弱的是_________(填元素符号)。在Z和W形成的原子个数比为1:1的化合物中,W的化合价是_________。
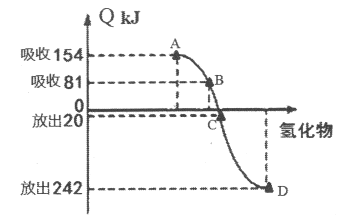
(4)元素M(Se)是人体必需的微量元素。Se能与H2反应生成H2Se,用原子结构解释原因_________。298K、1.01×105pa时,O2、S、Se、Te分别与H2化合生成1 mol气态氢化物时的热量的变化数据(Q)如下图所示。图中表示Se与H2化合的点是_________(填字母)。
【答案】K SiO2 2 SiO32- H2O Br +1 Se最外层6个电子,可以与H形成2对共用电子对 B
【解析】
由元素所在周期表中的位置可知,X为K元素,Y为Si元素,Z为Cl元素,M为Se元素,W为Br元素,据此分析。
由元素所在周期表中的位置可知,X为K元素,Y为Si元素,Z为Cl元素,M为Se元素,W为Br元素。
(1)X的元素符号是K;
(2)YO2是SiO2,是玻璃的成分之一,是酸性氧化物。实验室盛装NaOH溶液的试剂瓶不能用玻璃塞的原因是:SiO2+2OH-=SiO32-+ H2O;
(3)同主族从上而下非金属性逐渐减弱,故元素Z和元素W中,非金属性比较弱的是Br;在Z和W形成的原子个数比为1:1的化合物BrCl中,W的化合价是+1价;
(4)Se最外层6个电子,可以与H形成2对共用电子对,故Se能与H2反应生成H2Se;
能量越低越稳定,H2O、H2S、H2Se、H2Te稳定性减弱,所以B表示Te与H2化合的反应热数据。


科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个NH4+含有质子的物质的量是____ ,含有电子的物质的量是_____;
(2)200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为_____ ;
(3)标准状况下,36g H2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为______;
(4)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为____;
(5)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
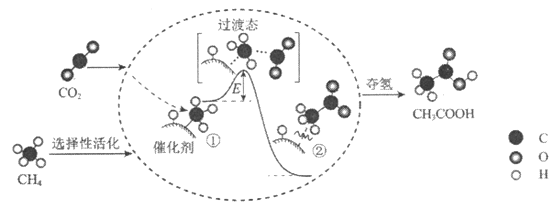
下列说法不正确的是
A. 该反应是化合反应
B. 催化剂参加了化学反应过程
C. CH4→CH3COOH过程中,有C—H键的断裂和形成
D. ①→②过程中,形成了C—C键,断裂的化学键的总键能<形成的化学键的总键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
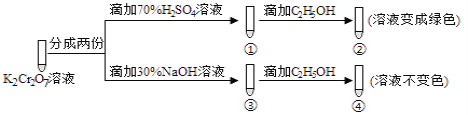
A. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B. ②中C2H5OH被Cr2O72-氧化成CH3COOH
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. ①中溶液橙色加深,③中溶液变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是

A.该过程中产生标准状况下的氢气4.48 L
B.向c点处的反应液中加入稀盐酸后无明显现象
C.图中a=1.5、b =1.5
D.当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上已合成了几百种有机超导体,TCNQ是其中之一。TCNQ的分子结构如下图所示.下列关于TCNQ说法错误的是 ( )
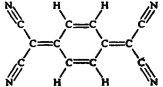
A. 分子中所有的氮原子可能在同一平面内
B. 属于芳香烃
C. 分子式为C12H4N4
D. 该物质难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应: 2SO2(g)+O2(g)![]() 2SO3(g)。当SO2、O2、 SO3的浓度不再变化时,下列说法正确的是
2SO3(g)。当SO2、O2、 SO3的浓度不再变化时,下列说法正确的是
A. SO2和O2全部转化为SO3
B. 正、逆反应速率相等且等于零
C. 该反应已达化学平衡状态
D. SO2、 O2、SO3的浓度一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com