
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
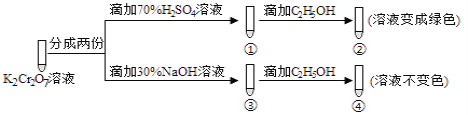
A. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B. ②中C2H5OH被Cr2O72-氧化成CH3COOH
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. ①中溶液橙色加深,③中溶液变黄
科目:高中化学 来源: 题型:
【题目】“苏丹红一号”(结构如下图所示)是一种合成染料,科学家通过经毒理学研究,发现长期食用含有苏丹红的食品对人体可能有致癌因素。下列关于“苏丹红一号”的说法中不正确的是

A. 属于芳香族化合物,分子式为C16H12N2O
B. 分子中的所有原子可能位于同一平面上
C. 分子中苯环上的一取代物共有11种
D. 能与NaOH溶液、FeCl3溶液、溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂2molH—H键
C. 混合气体分子的总数不变
D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:转化率=某一反应物转化的量÷该反应物的初始量×100%。在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t4时刻,该反应处于化学平衡状态
B. t3时,A的转化率比B的转化率高
C. t1至t2时刻,该反应的速率为3 mol·L-1 s-1
D. 该反应的化学方程式是:2A(g)+B(g)![]() C(g)
C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应。
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是_________(填化学式)。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是______________。
②乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL___mol/L ___溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1 mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2 (无氧)溶液中通入SO2 |
向烧杯中分别加入25mL 0.1 mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,向BaCl2溶液中持续通入SO2,溶液pH下降是因为_________(用方程式表示)。
(4)图2,BaCl2溶液中发生反应的离子方程式为___________。
(5)依据上述图像你得出的结论是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、W在周期表中的位置如图:
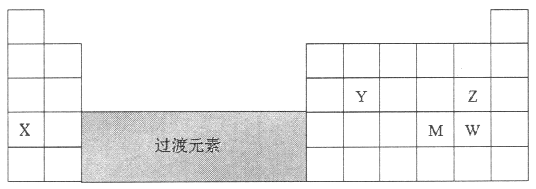
(1)X的元素符号是_________。
(2)YO2是玻璃的成分之一,是酸性氧化物。实验室盛装NaOH溶液的试剂瓶不能用玻璃塞的原因是:_________+_________OH-=_________+_________。
(3)元素Z和元素W中,非金属性比较弱的是_________(填元素符号)。在Z和W形成的原子个数比为1:1的化合物中,W的化合价是_________。
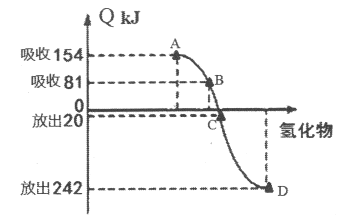
(4)元素M(Se)是人体必需的微量元素。Se能与H2反应生成H2Se,用原子结构解释原因_________。298K、1.01×105pa时,O2、S、Se、Te分别与H2化合生成1 mol气态氢化物时的热量的变化数据(Q)如下图所示。图中表示Se与H2化合的点是_________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=c(FeO)c(CO)/c(Fe)c(CO2)
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的能量示意图如下:
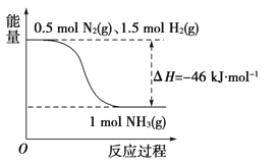
(1)已知分别破坏1 mol N![]() N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N-H键需要吸收的能量为________ kJ。
N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N-H键需要吸收的能量为________ kJ。
(2)N2H4可视为NH3分子中的H被—NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com