
【题目】(1)3.01×1023个NH4+含有质子的物质的量是____ ,含有电子的物质的量是_____;
(2)200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为_____ ;
(3)标准状况下,36g H2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为______;
(4)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为____;
(5)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是______。
【答案】5.5mol 5mol 6mol/L 2:1 3mol/L 124g/mol
【解析】
(1)根据n=![]() 计算物质的量,每个NH4+含有10个质子,10个电子;
计算物质的量,每个NH4+含有10个质子,10个电子;
(2)硫酸铝完全电离,硫酸根浓度为硫酸铝的3倍,据此计算;
(3)设氢气的物质的量为xmol,氧气的物质的量为ymol,依据n=![]() =
=![]() ,计算解答;
,计算解答;
(4)根据n=![]() 计算NH3的物质的量,再根据c=
计算NH3的物质的量,再根据c=![]() 计算物质的量浓度;
计算物质的量浓度;
(5)根据n=![]() =
=![]() 计算相关物理量。
计算相关物理量。
(1),3.01×1023个NH4+的物质的量n=![]() =
=![]() =0.5mol,含有质子的物质的量是0.5mo l×11=0.55mol,含有电子的物质的量是0.5mo l×10=0.5mol;
=0.5mol,含有质子的物质的量是0.5mo l×11=0.55mol,含有电子的物质的量是0.5mo l×10=0.5mol;
(2)硫酸铝完全电离,硫酸根浓度为硫酸铝的3倍,SO42-的物质的量浓度为2mol/L×3=6mol/L;
(3)设氢气的物质的量为xmol,氧气的物质的量为ymol,则:2x+18y=36,(x+y)×22.4L/mol=6.72L,解得:x=2,y=1,同温同压下,气体的体积之比等于物质的量之比所以这种混合气体中H2和O2的体积:2:1;
(4)标准状况下,将33.6LNH3的物质的量n=![]() =
=![]() =1.5mol,所得氨水的物质的量浓度c=
=1.5mol,所得氨水的物质的量浓度c=![]() =
=![]() =3mol/L;
=3mol/L;
(5)n(A)=![]() =0.25mol,则M=
=0.25mol,则M=![]() =124g/mol。
=124g/mol。


科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下,下列说法不正确的是
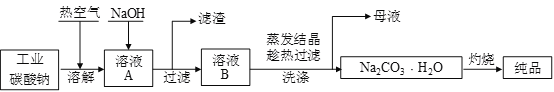
A. 步骤①,通入热空气可以将Fe2+氧化
B. 步骤②,产生滤渣的主要成分为Mg(OH)2和 Fe(OH)3
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3·H2O中混有Na2CO3·10H2O等杂质
D. 步骤④,灼烧Na2CO3·H2O在瓷坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某研究小组用下图所示的实验装置,利用氢氧化钠固体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理:2NH3(g) + CO2(g)=H2NCOONH4(s) ΔH<0。
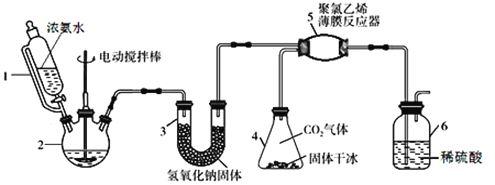
(1)实验室用98%的浓硫酸配制15%的稀硫酸,除量筒外还需使用下列仪器中的____。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)仪器1恒压分液漏斗,其优点是__________________________。
(3)仪器3中NaOH固体的作用是__________________________。
(4)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(5)另有一种制备氨基甲酸铵的反应器(CCl4与液体石蜡均为惰性介质)如图。生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。
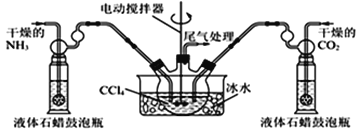
①发生器用冰水冷却的原因是________________________________________;
②从反应后混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_____(填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(6)已知氨基甲酸铵可完全水解,其中产物有碳酸氢铵。氨基甲酸铵水解反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂2molH—H键
C. 混合气体分子的总数不变
D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③B.②③④C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:转化率=某一反应物转化的量÷该反应物的初始量×100%。在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t4时刻,该反应处于化学平衡状态
B. t3时,A的转化率比B的转化率高
C. t1至t2时刻,该反应的速率为3 mol·L-1 s-1
D. 该反应的化学方程式是:2A(g)+B(g)![]() C(g)
C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、W在周期表中的位置如图:
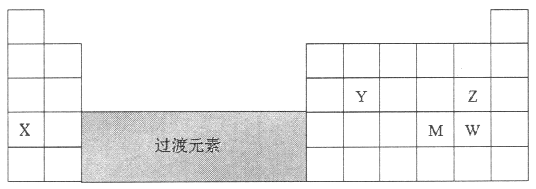
(1)X的元素符号是_________。
(2)YO2是玻璃的成分之一,是酸性氧化物。实验室盛装NaOH溶液的试剂瓶不能用玻璃塞的原因是:_________+_________OH-=_________+_________。
(3)元素Z和元素W中,非金属性比较弱的是_________(填元素符号)。在Z和W形成的原子个数比为1:1的化合物中,W的化合价是_________。
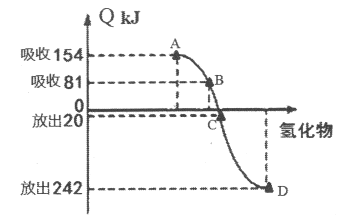
(4)元素M(Se)是人体必需的微量元素。Se能与H2反应生成H2Se,用原子结构解释原因_________。298K、1.01×105pa时,O2、S、Se、Te分别与H2化合生成1 mol气态氢化物时的热量的变化数据(Q)如下图所示。图中表示Se与H2化合的点是_________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学电源的叙述中正确的是
A. 比火力发电对化学能的利用率高
B. 所提供的电能居于人类社会现阶段总耗电量的首位
C. 都是安全、无污染的
D. 都为可充电电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com