
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
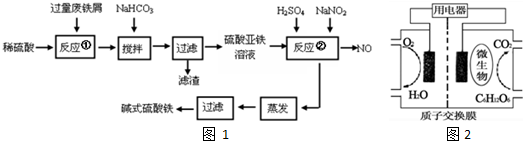
分析 I.废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应I中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,据此分析解答;
II.(5)在燃料电池2CH3COOK+4H2O+8K2S2O8═4CO2↑+7H2SO4+9K2SO4中是还原剂CH3COOK在负极发生氧化反应生成CO2,据此书写电极反应式;
(6)①根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O;
A.原电池正极发生得电子的还原反应,据此书写电极反应;
B.根据负极电极反应C6H12O6+6H2O-24e-=6CO2↑+24H+,可计算出每消耗90克葡萄糖,经外电路通过的电子数,并判断;
C.从蛋白质的性质:高温下会变性分析;
D.原电池中,阳离子向正极移动;
②化学需氧量(COD)是重要的水质指标,其数值表示将1L水中的有机物氧化为CO2、H2O时所需消耗的氧气的质量,依据化学需氧量含义计算有机物被氧化提供的化学能结合葡萄糖的氧化反应的热化学方程式计算需氧量;
解答 解:废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,然后反应I中加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以滤渣中成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO2,酸性条件下,NaNO2和FeSO4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,
(1)根据氢氧化物沉淀需要的pH知,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀,所以条件溶液的pH范围为4.4-7.5之间,
故答案为:4.4-7.5;Al 3+;
(2)因为氢氧化亚铁沉淀完全时pH值为9,所以若沉淀完全时溶液中金属离子浓度为1.0×10-5mol/L,则Ksp[Fe(OH)2]=1.0×10-5×(10-14+9)2=1.0×10-15,
故答案为:1.0×10-15;
(3)根据电子得失守恒可知,通入O2相当于NaNO2的用量的关系为O2~4NaNO2,若标况下有33.6L O2即为1.5mol参与反应,则相当于节约NaNO2的物质的量为6mol,
故答案为:6mol;
(4)该生产碱式硫酸铁的工艺过程中,由于用亚硝酸盐氧化亚铁离子会产生一氧化氮,所以会造成大气污染,所以存在的明显缺点是会产生一氧化氮,会造成大气污染,
故答案为:会产生一氧化氮,会造成大气污染;
II.(5)在燃料电池2CH3COOK+4H2O+8K2S2O8═4CO2↑+7H2SO4+9K2SO4中是还原剂CH3COOK在负极发生氧化反应生成CO2,所以负极电极反应式为CH3COO-+2H2O-8e-=2CO2↑+7H+,
故答案为:CH3COO-+2H2O-8e-=2CO2↑+7H+;
(6)①A.原电池正极发生得电子的还原反应,电极反应为O2+4e-+4H+═2H2O,故A错误;
B.根据负极电极反应C6H12O6+6H2O-24e-=6CO2↑+24H+,可知每消耗90克葡萄糖,经外电路通过的电子数为12NA,故B正确;
C.高温条件下微生物会变性,该电池不能够在高温下工作,故C错误;
D.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故D正确;
故选BD;
②依据题意写出葡萄糖氧化分解的热化学方程式为C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-2800kJ/mol,则1L废水中有机物氧化提供的化学能等于5.6kJ时所需引起氧气的质量变化量m(O2)=$\frac{32g/mol×6×5.6kJ}{2800kJ/mol}$=0.384g,相当于384mg,即其COD最低为 384mg/L,
故答案为:384.
点评 本题考查物质的分离和提纯及电化学知识、化学计算等,侧重考查学生获取信息及利用信息能力、分析能力、实验操作能力以及计算能力,注意题给信息的灵活运用及守恒思想的运用,题目难度中等.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和时所需HCl的量 | B. | NH3•H2O的电离常数 | ||
| C. | OH-的物质的量 | D. | OH-的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加入NaHCO3使氯水的漂白能力增强 | |
| C. | 难溶电解质可以由溶解度小的转化为溶解度更小的,但不能从溶解度小的转化为溶解度大的 | |
| D. | Ksp只受温度的影响,不受浓度的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性的共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10O的同分异构体有很多种,其中属于醇类的只有4种 | |
| B. | 水解得到的两种物质,C2H4O2可以与金属钠作用产生氢气,而C4H10O不可以 | |
| C. | 水解得到的物质C2H4O2和葡萄糖的最简式相同,所以二者的化学性质相似 | |
| D. | 该同学分离出的酯的化学式可表示为C6H12O2,它的同分异构体属于酯类的有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在其它条件相同时,将等质量的锌块和锌粉与相同浓度的盐酸反应,锌粉反应快 | |
| B. | 将质量相同、形状大小一样的铝条分别与稀硫酸和浓硫酸反应,浓硫酸产生氢气快 | |
| C. | 两支试管中分别加入双氧水,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 在稀硫酸和铁粉反应制取氢气时,加入适量醋酸钠晶体,可减慢反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com