
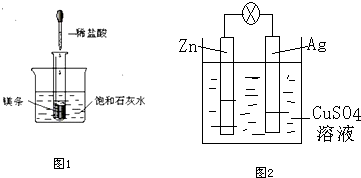
| A. | 在其它条件相同时,将等质量的锌块和锌粉与相同浓度的盐酸反应,锌粉反应快 | |
| B. | 将质量相同、形状大小一样的铝条分别与稀硫酸和浓硫酸反应,浓硫酸产生氢气快 | |
| C. | 两支试管中分别加入双氧水,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 在稀硫酸和铁粉反应制取氢气时,加入适量醋酸钠晶体,可减慢反应速率 |
分析 A.等质量的锌块和锌粉的接触面积不同;
B.浓硫酸具有强氧化性,与Al发生钝化;
C.加入少量二氧化锰作催化剂;
D.加入适量醋酸钠晶体,与硫酸结合生成醋酸电离出氢离子浓度小.
解答 解:A.等质量的锌块和锌粉的接触面积不同,接触面积大的反应速率快,故A正确;
B.浓硫酸具有强氧化性,与Al发生钝化,不能生成氢气,故B错误;
C.加入少量二氧化锰作催化剂,则加催化剂的反应速率快,故C正确;
D.加入适量醋酸钠晶体,与硫酸结合生成醋酸电离出氢离子浓度小,则氢离子减小可减慢反应速率,故D正确;
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握接触面积、催化剂、浓度等对反应速率的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指大气中直径≤2,5微米的颗粒物也称为可入肺颗粒物,对人体危害最大是因为它可以直接进入肺泡 | |
| B. | 雾霾是因为汽车排放尾气,工厂排放废气,燃烧烟花爆竹、烹饪等原因所造成的 | |
| C. | 化石能源不仅不可再生,而且在燃烧过程中会产生染污性物质,因此应不再使用化石能源,这符合绿色化学的核心 | |
| D. | 对煤进行气化、液化、脱硫等处理,不仅可以提高其利用率,而且可以降低对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性比强酸弱 | |
| B. | 10 mL 1 mol/L的HA溶液与10 mL 1 mol/L的NaOH溶液恰好完全反应 | |
| C. | NaA溶液的pH>7 | |
| D. | 0.1 mol/L HA溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
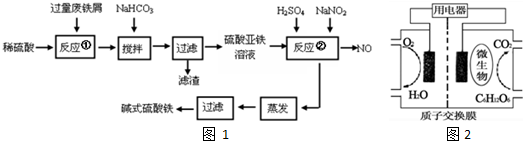
 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
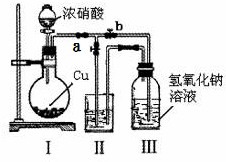
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾中含有氧元素,属于氧化物 | |
| B. | 一氧化碳中含有碳元素,属于有机物 | |
| C. | 纯碱溶液显碱性,属于碱 | |
| D. | 绿矾的化学式为FeSO4•7H2O,属于纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
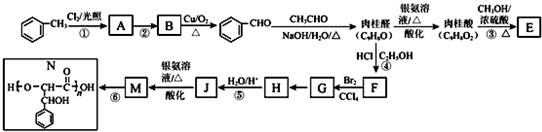
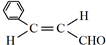 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com