
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | FeCl3溶液腐蚀印刷电路:Fe3++Cu=Fe2++Cu2+? |
分析 A.碘离子过量,硝酸根离子、三价铁离子都被还原;
B.高锰酸根离子酸性环境下氧化亚硝酸根离子生成硝酸根离子;
C.氢氧化钡过量反应生成碳酸钡、碳酸氢钠和水;
D.电荷不守恒.
解答 解:A.硝酸铁溶液中滴加足量HI溶液,铁离子和硝酸根离子都参与反应,离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故A错误;
B.NaNO2溶液中加入酸性KMnO4溶液,离子方程式:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O,故B正确;
C.NaHCO3溶液中加入过量的Ba(OH)2溶液,离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O,故C错误;
D.FeCl3溶液腐蚀印刷电路,离子方程式:2Fe3++Cu=2Fe2++Cu2+?,故D错误;
故选:B.
点评 本题考查了离子方程式的书写判断,题目难度中等,学生灵活应用基础知识的能力,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、原子个数、电荷数守恒规律.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
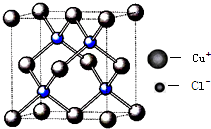 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (PX)+12MnO4-+36H+→5
(PX)+12MnO4-+36H+→5  (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | PTA 是该反应的氧化产物 | |
| B. | PTA 与乙二醇通过缩聚反应即可生产 PET 塑料 | |
| C. | PX 分子含有苯环的同分异构体还有 3 种 | |
| D. | 该反应消耗 1molPX,共转移 10mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛和甲酸两者都能发生银镜反应,所以它们互为同系物 | |
| B. | 营养物质中的多糖、油脂、蛋白质在一定条件下都可以发生水解 | |
| C. | 氨基酸和氯乙烯都能通过加聚反应生成高分子化合物 | |
| D. | 通过对煤的分馏,可以提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
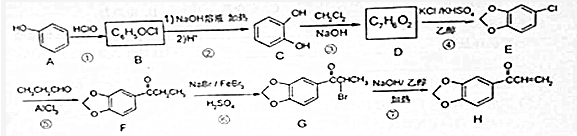
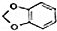 .
.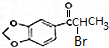 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O.
+NaBr+H2O. 等(写出其中一种的结构简式).
等(写出其中一种的结构简式). 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成有机物的骨干元素是碳 | |
| B. | 构成地壳的骨干元素是Si,在二氧化硅晶体中每个Si原子周围结合4个O原子,每个O原子周围结台2个Si原子,[SiO4]四面体向空间无限伸展,形成立体网状结构 | |
| C. | 单质Si是制作计算机芯片的主要材料,SiO2是制取光导纤维的主要材料 | |
| D. | 空气中含量最大的元素是N.海水中含量最大的元索是C1,太阳系中含量最大的元素是H |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CH3COOCH2CH3+H2O;苯制取环己烷:
CH3COOCH2CH3+H2O;苯制取环己烷: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
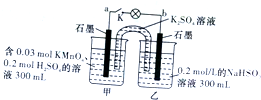
| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com