
ЁОЬтФПЁПдкtЁцЪБЃЌНЋagNH3ЭъШЋШмгкЫЎЃЌЕУЕНVmLШмвКЃЌЩшИУШмвКЕФУмЖШЮЊІбgЁЄcm-3ЃЌжЪСПЗжЪ§ЮЊІиЃЌЦфжаКЌNH4+ЕФЮяжЪЕФСПЮЊbmolЁЃЯТСаа№ЪіжаВЛе§ШЗЕФЪЧ
A.ШмжЪЕФжЪСПЗжЪ§Іи=![]() ЁС100%
ЁС100%
B.ШмжЪЕФЮяжЪЕФСПХЈЖШc=1000a/17VmolЁЄL-1
C.ШмвКжаc(OH-)=1000b/VmolЁЄL-1+c(H+)
D.ЩЯЪіШмвКжадйМгШыVmLЫЎКѓЃЌЫљЕУШмвКжаШмжЪЕФжЪСПЗжЪ§аЁгк0.5Іи
ЁОД№АИЁПA
ЁОНтЮіЁП
A. ШмжЪЕФжЪСПЗжЪ§Іи=![]() ЁС100%=a/ІбV
ЁС100%=a/ІбV![]() 100%ЃЌЗћКЯЬтвтЃЌAбЁЃЛ
100%ЃЌЗћКЯЬтвтЃЌAбЁЃЛ
B. ШмжЪЕФЮяжЪЕФСПХЈЖШc=n/V=1000a/17VmolЁЄL-1ЃЌгыЬтвтВЛЗћЃЌBВЛбЁЃЛ
C. ШмвКжаNH3![]() H2O
H2O![]() NH4++ OH-ЃЌH2O
NH4++ OH-ЃЌH2O![]() H++ OH-ЃЌдђc(OH-)=cЃЈNH4+ЃЉ+ cЃЈH+ЃЉ=1000b/VmolЁЄL-1+c(H+)ЃЌгыЬтвтВЛЗћЃЌCВЛбЁЃЛ
H++ OH-ЃЌдђc(OH-)=cЃЈNH4+ЃЉ+ cЃЈH+ЃЉ=1000b/VmolЁЄL-1+c(H+)ЃЌгыЬтвтВЛЗћЃЌCВЛбЁЃЛ
D. ЩЯЪіШмвКжадйМгШыVmLЫЎКѓЃЌШмжЪЕФжЪСПВЛБфЃЌЫљЕУШмвКжаШмжЪЕФжЪСПЗжЪ§=a/ЃЈІбV+V![]() 1ЃЉЃЌАБЫЎЕФУмЖШаЁгк1ЃЌІбV<V
1ЃЉЃЌАБЫЎЕФУмЖШаЁгк1ЃЌІбV<V![]() 1ЃЌдђжЪСПЗжЪ§аЁгк0.5ІиЃЌгыЬтвтВЛЗћЃЌDВЛбЁЃЛ
1ЃЌдђжЪСПЗжЪ§аЁгк0.5ІиЃЌгыЬтвтВЛЗћЃЌDВЛбЁЃЛ
Д№АИЮЊAЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЂйНЈжўЩЯашвЊгУЕНДѓСПЫЎФрЁЂВЃСЇЁЃЩњВњЫЎФрЁЂВЃСЇжаЖМгУЕНЕФжївЊдСЯЮЊ_____(ЬюзжФИ)ЁЃ
a. ДПМю b. ЪЏЛвЪЏ c. №ЄЭС
ЂкЦћГЕЙЄвЕДѓСПЪЙгУЯ№НКТжЬЅЃЌЯ№НКЪєгк____________(ЬюзжФИ)ЁЃ
a. ЮоЛњЗЧН№ЪєВФСЯ b. Н№ЪєВФСЯ c. гаЛњИпЗжзгВФСЯ
ЂлЯжДњЧХСКНЈдьашвЊЪЙгУДѓСПИжВФ,ЦфжаЖЦаПИжАхЖЦаПЕФжївЊФПЕФЪЧ_________ (ЬюзжФИ)ЁЃ
a. УРЛЏЧХСК b. ЬсИпгВЖШ c. ЬсИпФЭИЏЪДад
ЃЈ2ЃЉбѓМЛБЛШЫУЧЙквдЁАЪпВЫжЎЛЪЁБЕФУРГЦ,КЌгажЌЗОЁЂЕААзжЪЁЂЬЧРрЁЂЮЌЩњЫиAЁЂЮЌЩњЫиCКЭЗсИЛЕФИЦЁЂСзЁЂЬњЕШдЊЫи,Цфжа:
ЂйЪєгкЫЎШмадЮЌЩњЫиЕФЪЧ_____________ЁЃ
ЂкЪєгкШЫЬхЫљашЮЂСПдЊЫиЕФЪЧ_____________ЁЃ
ЂлжЌЗОдкШЫЬхФкЫЎНтЩњГЩИпМЖжЌЗОЫсКЭ_____________________ЃЛЬЧРрдкШЫЬхжаЫЎНтЩњГЩЦЯЬбЬЧ,аДГіЦЯЬбЬЧдкШЫЬхФкбѕЛЏЕФЛЏбЇЗНГЬЪН:________________________________________________ЁЃ
ЃЈ3ЃЉКЯРэРћгУздШЛзЪдД,ЗРжЙЛЗОГЮлШОКЭЩњЬЌЦЦЛЕЁЃ
ЂйЯђШМУКжаМгШыЪЪСПЪЏЛвЪЏ,ПЩДѓДѓМѕЩй______________ЕФХХЗХЁЃУКЕФЦјЛЏЪЧЪЕЯжФмдДЧхНрЛЏЕФживЊЭООЖ,ЫЎУКЦјЕФжївЊГЩЗжЪЧCOКЭ_____________ЁЃ
ЂкУїЗЏЪЧвЛжжГЃгУЕФЛьФ§МС,ЦфОЛЫЎдРэЪЧ___________________________ (гУРызгЗНГЬЪНБэЪО)ЁЃЮлЫЎДІРэЕФЗНЗЈКмЖрЃЌДгЛЏбЇНЧЖШПДЃЌДІРэЫсадЗЯЫЎПЩВЩгУ________(бЁЬюЁАжаКЭЗЈЁБЛђЁАГСЕэЗЈЁБ)ЁЃ
ЂлЮвЙњПЦбЇМвжЄУїСЫЛЦЗлГцЕФгзГцПЩНЕНтОлБНввЯЉ(![]() )етРрФбвдздШЛНЕНтЕФЫмСЯЁЃЧыаДГігЩБНввЯЉКЯГЩОлБНввЯЉЕФЛЏбЇЗНГЬЪН:__________________________________________ЁЃ
)етРрФбвдздШЛНЕНтЕФЫмСЯЁЃЧыаДГігЩБНввЯЉКЯГЩОлБНввЯЉЕФЛЏбЇЗНГЬЪН:__________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвФЃФтЙЄвЕЩЯКюЕТАёжЦМюдРэжЦБИДПМюЃЌЯТСаВйзїЮДЩцМАЕФЪЧ
A.  B.
B.  C.
C.  D.
D. 
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяMПЩгУгкЯћЖОМСЁЂПЙбѕЛЏМСЁЂвНвЉжаМфЬхЁЃЪЕбщЪвгЩЗМЯуЬўAжЦБИMЕФвЛжжКЯГЩТЗЯпШчЯТЃК

ЧыЛиД№ЃК
(1)BЕФЛЏбЇУћГЦЮЊ___________ЃЛDжаЙйФмЭХЕФУћГЦЮЊ______________________ЁЃ
(2)гЩFЩњГЩGЕФЗДгІРраЭЮЊ___________ЃЛFЕФЗжзгЪНЮЊ___________ЁЃ
(3)гЩEзЊЛЏЮЊFЕФЕквЛВНЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______________________ЁЃ
(4)MЕФНсЙЙМђЪНЮЊ___________ЁЃ
(5)ЗМЯуЛЏКЯЮяQЮЊCЕФЭЌЗжвьЙЙЬхЃЌQФмЗЂЩњвјОЕЗДгІЃЌЦфКЫДХЙВеёЧтЦзга4зщЮќЪеЗхЁЃаДГіЗћКЯвЊЧѓЕФQЕФвЛжжНсЙЙМђЪН______________________ЁЃ
(6)ВЮееЩЯЪіКЯГЩТЗЯпКЭаХЯЂЃЌвдБНМзЫсввѕЅКЭCH3MgBrЮЊдСЯ(ЮоЛњЪдМСШЮбЁ)ЃЌЩшМЦжЦБИ ЕФКЯГЩТЗЯп_________________________________ЁЃ
ЕФКЯГЩТЗЯп_________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉ25 ЁцЪБЃЌжЦБИбЧЯѕѕЃТШЫљЩцМАЕФШШЛЏбЇЗНГЬЪНКЭЦНКтГЃЪ§ШчБэЃК
ШШЛЏбЇЗНГЬЪН | ЦНКтГЃЪ§ | |
Ђй | 2NO2(g)+NaCl(s) | K1 |
Ђк | 4NO2(g)+2NaCl(s) | K2 |
Ђл | 2NO(g)+Cl2(g) | K3 |
дђИУЮТЖШЯТЃЌІЄH3=_______________kJmol-1ЃЛK3=_____________ЃЈгУK1КЭK2БэЪОЃЉЁЃ
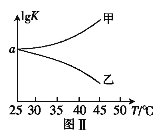
ЃЈ2ЃЉ25ЁцЪБЃЌдкЬхЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаЭЈШы0.08 mol NOКЭ0.04 molCl2ЗЂЩњЩЯЪіЗДгІЂлЃЌШєЗДгІПЊЪМгыНсЪјЪБЮТЖШЯрЭЌЃЌЪ§зжбЙЧПвЧЯдЪОЗДгІЙ§ГЬжабЙЧП(p)ЫцЪБМф(t)ЕФБфЛЏШчЭМЂёЪЕЯпЫљЪОЃЌдђІЄH3 ___ЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉ0ЃЛШєЦфЫћЬѕМўЯрЭЌЃЌНіИФБфФГвЛЬѕМўЃЌВтЕУЦфбЙЧПЫцЪБМфЕФБфЛЏШчЭМЂёащЯпЫљЪОЃЌдђИФБфЕФЬѕМўЪЧ_____________ЃЛдк5 minЪБЃЌдйГфШы0.08 mol NOКЭ0.04 molCl2ЃЌдђЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПНЋ_____________ЃЈЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃЭМЂђЪЧМзЁЂввСНЭЌбЇУшЛцЩЯЪіЗДгІЂлЕФЦНКтГЃЪ§ЕФЖдЪ§жЕЃЈlgKЃЉгыЮТЖШЕФБфЛЏЙиЯЕЭМЃЌЦфжае§ШЗЕФЧњЯпЪЧ______ЃЈЬюЁАМзЁБЛђЁАввЁБЃЉЃЌaжЕЮЊ__________ЁЃ25 ЁцЪБВтЕУЗДгІЂлдкФГЪБПЬЃЌNO(g)ЁЂCl2(g)ЁЂNOCl(g)ЕФХЈЖШЗжБ№ЮЊ0.8ЁЂ0.1ЁЂ0.3ЃЌдђДЫЪБvе§_________vФцЃЈЬюЁА>ЁБЁАЃМЁБЛђЁА=ЁБЃЉ

(3)дк300 ЁцЁЂ8 MPaЯТЃЌНЋCO2КЭH2АДЮяжЪЕФСПжЎБШ1ЁУ3 ЭЈШывЛУмБеШнЦїжаЗЂЩњCO2(g)ЃЋ3H2(g)![]() CH3OH(g)ЃЋH2O(g)жаЗДгІЃЌДяЕНЦНКтЪБЃЌВтЕУCO2ЕФЦНКтзЊЛЏТЪЮЊ50%ЃЌдђИУЗДгІЬѕМўЯТЕФЦНКтГЃЪ§ЮЊKpЃН_____(гУЦНКтЗжбЙДњЬцЦНКтХЈЖШМЦЫуЃЌЗжбЙЃНзмбЙЁСЮяжЪЕФСПЗжЪ§)ЁЃ
CH3OH(g)ЃЋH2O(g)жаЗДгІЃЌДяЕНЦНКтЪБЃЌВтЕУCO2ЕФЦНКтзЊЛЏТЪЮЊ50%ЃЌдђИУЗДгІЬѕМўЯТЕФЦНКтГЃЪ§ЮЊKpЃН_____(гУЦНКтЗжбЙДњЬцЦНКтХЈЖШМЦЫуЃЌЗжбЙЃНзмбЙЁСЮяжЪЕФСПЗжЪ§)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇЗДгІ2NOЃЈgЃЉ+O22NO2ЃЈgЃЉЃЌдкЦфЫћЬѕМўЯрЭЌЪБЃЌВтЕУЪЕбщЪ§ОнШчЭМЁЃЧыИљОнЭМЪОЪ§ОнЃЌЯТСагаЙиИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A. ЯрЭЌЬѕМўЯТЃЌЛЏбЇЗДгІЫйТЪЫцЪБМфдНРДдНПь
B. ЯрЭЌЬѕМўЯТЃЌбЙЧПдНДѓЃЌЛЏбЇЗДгІЫйТЪдНПь
C. ЯрЭЌЬѕМўЯТЃЌЮТЖШдНИпЃЌЛЏбЇЗДгІЫйТЪдНПь
D. дк0.1MPaЁЂ90ЁцЬѕМўЯТЃЌЗДгІ20sЪБДяЕНЛЏбЇЦНКтзДЬЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯЁбЮЫсКЭАБЫЎАДВЛЭЌЬхЛ§БШЛьКЯЕУЕНЫФжжШмвКЃЌИїШЁ20mLШмвКЃЌгУ0.1molLЉ1NaOHШмвКЕЮЖЈЃЌШмвКЕФpHЫцNaOHШмвКЕФЬхЛ§БфЛЏШчЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A. ЕЮжСpHЃН7ЪБЃЌЫФжжШмвКжаОљДцдкcЃЈNa+ЃЉЃНcЃЈClЉЃЉ
B. дбЮЫсЕФХЈЖШЪЧ0.1molLЉ1
C. VЃЈNaOHЃЉЃН10mLЃЌШмвКжаNa+ХЈЖШaЃОb
D. ЕБVЃЈNaOHЃЉЃО20mLЪБЃЌЫФжжШмвКЕФpHЯрЭЌЃЌШмвКжаЕФNH4+ХЈЖШНќЫЦЯрЕШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЌЗжвьЙЙЬхжИЕФЪЧЯрЭЌЗжзгЪНВЛЭЌЗжзгНсЙЙЕФЛЏКЯЮяЃЌЫќУшЪіЕФЖдЯѓжїЬхЪЧЛЏКЯЮяЁЃЭЌЫивьаЮЬхЁЂЭЌЮЛЫиЁЂЭЌЯЕЮяУшЪіЕФЖдЯѓжїЬхвРДЮЮЊ
A.ЕЅжЪЁЂдзгЁЂЛЏКЯЮяB.дЊЫиЁЂЕЅжЪЁЂЛЏКЯЮя
C.ЮоЛњЛЏКЯЮяЁЂдЊЫиЁЂгаЛњЛЏКЯЮяD.дзгКЫЁЂдзгЁЂЗжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЃЫЎОЙ§ЩЙбЮКѓЕУЕНДжбЮКЭПрТБЃЌДжбЮжаГ§КЌгаCa2+ЃЌMg2+ЃЌSO42ЉЕШПЩШмаддгжЪЭтЃЌЛЙКЌгаФрЩГЕШВЛШмаддгжЪЃЌЪГгУЕФОЋбЮЪЧгУДжбЮЬсДПЕУЕНЃЌСїГЬШчЭМЫљЪОЃК

ЃЈ1ЃЉЮЊСЫГ§ШЅДжбЮжаЕФCa2+ЃЌMg2+ЃЌSO42ЉЃЌВЩШЁвдЯТДыЪЉЃК
aЃЎДжбЮжаКЌгаЕФ Ca2+ЁЂMg2+ЃЌОЋжЦЙ§ГЬжаЮЊГ§ШЅетСНжжРызгЃЌЗЂЩњЕФРызгЗДгІЗНГЬЪНЗжБ№ЮЊЃК_____ЃЌ_____ЁЃ
bЃЎШєДжбЮжаSO42ЉКЌСПНЯИпЃЌБиаыЬэМгБЕЪдМСГ§ШЅSO42ЉЃЌИУБЕЪдМСПЩвдЪЧ_____
AЃЎBa(OH)2
BЃЎBa(NO3)2
CЃЎBaCl2
DЃЎBaSO4
ЕЮМгБЕЪдМСЪБЃЌашзЂвтЃЈЕЮМгЪдМСЕФЯШКѓЫГађЃЉЃК_____ЁЃ
ЃЈ2ЃЉЗжРыГіДжбЮКѓЕФПрТБЛЙПЩгУгкфхдЊЫиЕФЬсШЁЃЌдкЪЕбщЪвжаШчКЮбщжЄПрТБвКжаКЌга BrЉЃК_____ЁЃ
ЃЈ3ЃЉдкПрТБЬсфхЕФЙ§ГЬжаЃЌЕкЂнВНжшжаПЩгУбЧСђЫсФЦШмвКРДЮќЪеЃЌдђЫљЗЂЩњЕФРызгЗДгІЗНГЬЪНЮЊЃК_____ЃЌВНжшЂржафхеєЦјРфФ§КѓЕУЕНвКфхгыфхЫЎЕФЛьКЯЮяЃЌПЩРћгУЫќУЧЕФЯрЖдУмЖШ ЯрВюКмДѓЕФЬиЕуНјааЗжРыЁЃШєдкЪЕбщЪвЗжРыЩЯЪіЛьКЯЮяЕФЗжРывЧЦїЕФУћГЦЪЧ_____ЃЌЗжРыЪБвК фхДгЗжРыЦїЕФ_____ЃЈЬюЁАЩЯПкЁБЛђЁАЯТПкЁБЃЉХХГіЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com