
【题目】下列有关胶体的说法正确的是
A. 有的胶体是纯净物,有的胶体是混合物
B. 有的胶体带电,有的胶体不带电
C. 工厂中常用的静电除尘装置是根据胶体的某些性质设计的
D. 胶体、溶液和浊液的本质区别是能否产生丁达尔效应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(I)利用反应CuSO4+Fe===Cu+FeSO4可设计为原电池。
(1)负极材料是________(写名称),电极反应为__________________________________。
(2)正极电极反应式为______________________。
(3)溶液中SO42-向________极移动。
(II)工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
(4)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总理论数值,其原因是____________________________。
(5)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(6)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.反应达到最大限度 d.N2和H2的浓度相等
e.生成1 mol N2的同时,消耗2 mol NH3 f.生成3 mol H2的同时,生成2 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )

A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)![]() xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
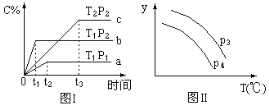
A. P3>P4,y轴表示B的转化率 B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度 D. P3>P4,y轴表示混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见有机反应属于加成反应的是
A.苯乙烯使酸性高锰酸钾溶液褪色B.油脂的皂化反应
C.丙醛在镍的催化下与氢气反应D.甲苯制备TNT(三硝基甲苯)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合忽略体积变化;计算结果保留到小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入_________mL。
(2)若用pH=2的盐酸,应加入_________mL。
(3)若用水稀释,则加入水的体积为____________________ mL。
(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=11的NaOH溶液中由水电离出的H+浓度为c2,则c1/c2=_________。
(5)常温下,pH=11的NaOH溶液aL与pH=5的H2SO4溶液bL混合,若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值减小,可以采取的措施是
A. 通入少量HCl气体 B. 升高温度
C. 加少量醋酸钠晶体 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可反应生成溴苯和溴化氢,此反应为放热反应,他们用图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(此时A下端活塞关闭)中。
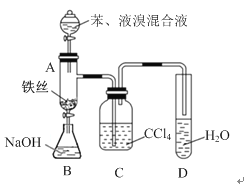
(1)写出A中反应的化学方程式__________________;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________,写出有关的离子方程式____________________;生成的有机物物位于溶液______层(填“上”或“下”)。
(3)C中盛放CCl4的作用是______________________;
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生________,则能证明;另一种验证的方法是向试管D滴加_____________,溶液变红色则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素在生活、生产和科技等方面有广泛的用途。
(1)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________(填序号)。
A.PFS中铁显+2价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
Mn | Fe | ||
电离能 | I1 | 717 | 759 |
(kJ·mol-1) | I2 | 1 509 | 1 561 |
I3 | 3 248 | 2 957 |
(2)PFS中SO42-采取__________杂化,空间构型是_________。
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬与甲基丙烯酸根的配合物为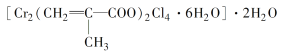
①该化合物中铬的化合价为___________。
②该化合物中一个Cr的配位数为________。
③甲基丙烯酸分子中C原子的杂化方式有___________________________________。
(4)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为__________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com