
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的( )
A.②④
B.③⑤
C.①②④
D.①③⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)步骤Ⅰ中所用的试剂是______________。
(2)步骤Ⅲ中反应的离子方程式是_________________。
(3)步骤Ⅴ可选用的试剂是__________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤Ⅵ的实验操作是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
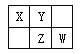
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
① | ||||||
② | ③ | ④ | ||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑦在元素周期表位置是________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)。________________________
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)_______________。
(4)由①和④组成的元素质重比为1:8的化合物的电子式是_________。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为。______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl2和碱溶液在不同条件下,得到的产物不同。某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。(3Cl2+6KOH![]() KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )

图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过___________________(填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的化学方程式为________________________________________________。
(2)反应完毕,B试管中有少量晶体析出,经冷却后,有大量晶体析出,从B的试管中分离出该晶体的操作为______________________________。
(3)该小组同学发现制得的氯酸钾产量偏低,分析可能的一种原因是Cl2中含有HCl气体,为了提高氯酸钾的产量,请你设计合理的实验改进方法________________________________________。
(4)实验中可观察到D试管中紫色石蕊试液先变成__________色,后变成_________色。
(5)请在装置图方框中画出缺少的实验装置,并注明试剂________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式____ 。
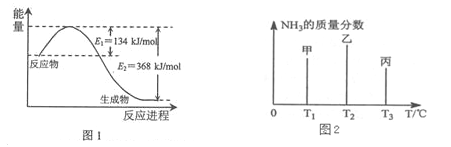
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
此时甲、乙、丙三个容器中一定达到化学平衡状态的是 容器,都达到平衡状态时,NH3的质量分数最高的是 容器(填甲、乙、丙)。
下图3是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.10 mol/L,c(H2) = 0.26 mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示。
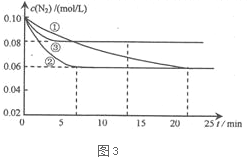
Ⅰ该反应实验②平衡时H2的转化率为 。
Ⅱ据图3所示,②装置中有一个条件与①不同,请指出②相对①改变的条件 。
Ⅲ计算实验③的平衡常数为___________________。
(3)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO +NO2 +H2O(方程式未配平)。3.2 g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是

A.该过程中产生标准状况下的氢气4.48 L
B.向c点处的反应液中加入稀盐酸后无明显现象
C.图中a=1.5、b =1.5
D.当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. CO2可作为镁带燃烧的灭火剂 B. 小苏打可用于焙制糕点
C. Cl2可用于自来水的消毒 D. 硅酸钠可作建筑业的黏合剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:__________________
(2)已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:__________________
(3)已知断裂1 mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O为464、请根据N2H4(l) +O2(g)= N2(g) +2H2O(g) ΔH2=-534kJ·mol-1中数据计算断裂1 molN-H键所需的能量(kJ)是:__________________
(4)写出NH3与NaClO反应得到肼的化学方程式:____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com