
科目:高中化学 来源: 题型:阅读理解
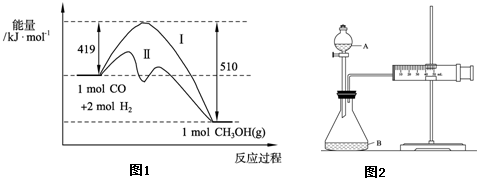
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逐渐减小 | B、逐渐增大 | C、不变 | D、先减小后增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
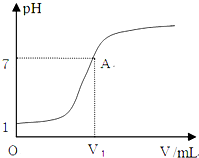 常温下,向10mL 0.1mol?L-1HCl溶液中逐滴加入0.1mol?L-1氨水,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1HCl溶液中逐滴加入0.1mol?L-1氨水,所得滴定曲线如图所示.下列说法正确的是( )| A、V1=10 mL | B、恰好中和时,溶液中:c(Cl-)≤c(NH4+) | C、A点溶液中存在:c(NH4+)=c(Cl-)=c(OH-)=c(H+) | D、当加入氨水的体积等于或小于10mL时,溶液中可能存在c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH | B、向10mL 0.1mol/L的AgNO3溶液中滴加10滴0.1mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度小于AgI的溶解度 | C、向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 | D、取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com