
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。

②
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
(4)在________(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH )3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如右图所示。

①写出甲池的A极电极反应式:______________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______。
A.H2SO4
B.BaSO4
C.Na2SO4
D.NaOH
E.CH3CH2OH
【答案】
(1)CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
(2)462;(3)510;(4)低温;
(5)①CH3OH-6e-+8OH-=CO32-+6H2O;②C。
【解析】
试题分析:(1)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物。由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,又已知:②CO(g)+![]() O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+
O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1,故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1,故答案为:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
(2)已知:H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+![]() O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+
O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+![]() ×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,故答案为:462;
×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,故答案为:462;
(3)根据图像,甲醇气体分解为CO和H2两种气体的反应的活化能=91 kJ/mol +419 kJ/mol =510 kJ/mol,故答案为:510;
(4)CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol的△H<0、△S<0,△H-T△S<0反应自发进行,故在低温下反应具有自发性,故答案为:低温;
(5)①甲池的A极为负极,发生氧化反应,电极反应式为CH3OH - 6e- + 8OH- =CO32- + 6H2O,故答案为:CH3OH - 6e- + 8OH- =CO32- + 6H2O;
②A


科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 铝与氢氧化钠溶液反应 :2Al +2 OH-=2AlO2-+3H2O
B. 将磁性氧化铁溶于盐酸:![]()
C. 用氢氧化钠溶液除去铝表面的氧化膜:![]()
D. 过氧化钠溶于盐酸:Na2O2+2H+=2Na++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O
B.氯化铁溶液和铜反应:Fe3++Cu=Cu2++Fe2+
C.NaHSO4溶液与NaOH溶液反应:OH-+HSO4-=SO42-+H2O
D.NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1[
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,
则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13 6C呼气法在医学上常用于幽门螺旋杆菌的诊断。下列关于13 6C的说法中正确的是
A. 质子数是6 B. 质量数是6 C. 电子数是13 D. 中子数是13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空:
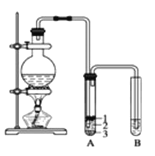
(1)盛放反应物的仪器名称是________,其中加入的反应物是溴化钠、 和 1∶1的硫酸。
(2)将生成物导入盛有冰水混合物的试管 A中,冰水混合物的作用是_____________。试管 A中的物质分为三层(如图所示),产物在第___________层。
(3)试管 A中除了产物和水之外,还可能存在_________、________(写出化学式)。
(4)用浓的硫酸进行实验,若试管 A中获得的有机物呈棕黄色,除去其中杂质的正确方法是______(选填编号)。
a.蒸馏
b.用氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(5)若试管 B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某难溶于水的化合物粉末中除含有碳粉外,还可能含有铁、铝的单质和它们的某一种氧化物。某校实验小组通过实验确定该混合物粉末的成分。
实验步骤:
①取m g固体粉末于一烧杯中,加入足量NaOH稀溶液,有气体放出,过滤得到固体A和无色溶液B;
②将①中所得固体A洗涤后分成两份。一份加入CuSO4溶液,无明显变化;另
一份加入足量稀硫酸,过滤得到固体C和棕黄色溶液D。
请回答下列问题:
(1)写出步骤①中发生反应的离子方程式____________________
(2)固体C的一种氧化物与过氧化钠发生反应的化学方程式为__________________。
(3)向棕黄色溶液D中加入铁粉,发生反应的离子方程式为_________________。
(4)由上述实验可以得出结论:混合物粉末中一定含有碳和________(填化学式,下同),含铁元素的物质可能是________或________。若要确定含铁元素的物质,还需要进一步实验,该实验方法为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,

请回答:
(1)物质X是___________(填化学式,下同),A是_____,B是______。
(2)写出反应的化学方程式:
C→E:________________________________;
G→E:_______________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com