
| 盐溶液 | NaCl | Na2CO3 | NH4Cl、 | CH3COONa | Na2SO4 |
| PH值 |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
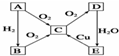 已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题:
已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若混合后c(CH3COO-)>c(Na+),则混合液一定呈碱性 |
| B、常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7 |
| C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA?)+2c(A2-) |
| D、将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯甲醛在一定条件下能发生银镜反应 |
| B、用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、乙酸乙酯和食用植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| B、做银镜反应后试管壁上银镜,用稀氨水洗涤 |
| C、将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基 |
| D、不慎将苯酚溶液沾到皮肤上,立即用NaOH溶液清洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com