
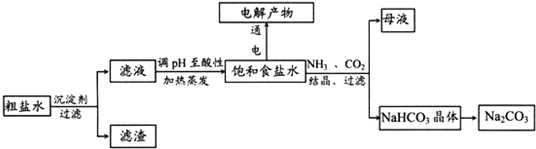
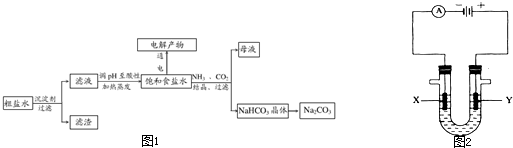
以食盐为原料进行生产并综合利用的某些过程如下图所示:

(1)为除去粗盐中的Ca2+、Mg2+和SO ,得到纯净的NaCl晶体,需加入以下试剂:A.过量的NaOH溶液;B.过量的Na2CO3溶液;C.适量的盐酸;D.过量的BaCl2溶液。
,得到纯净的NaCl晶体,需加入以下试剂:A.过量的NaOH溶液;B.过量的Na2CO3溶液;C.适量的盐酸;D.过量的BaCl2溶液。
正确的加入顺序是_______,还缺少的操作步骤是__________和___________。
(2)将滤液的pH调至酸性除去的离子是________,发生反应的离子方程式为________。
(3)若用惰性电极电解200mL1.5mol/L食盐水,当电解2min时,两极共收集到448mL气体(标准状况下)。假设电解前后溶液的体积不变,则电解后该溶液的pH为______。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是___________。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)_____________。
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。则反应前的溶液中与反应后的滤液中水电离出的 (OH-)的比值是_________。
(OH-)的比值是_________。
(1) adbc或dabc (2分) 过滤和蒸发结晶 (2分)
(2)OH-和CO32- (2分) H+ + OH- = H2O (1分) CO32- + 2H+ = CO2↑+ H2O (1分)
(3)13 (2分)
(4)NH3 (1分)
 (5)① CO32-
+ H2O HCO3-
+ OH- 碱性溶液可除油污 (2分)
② 1010∶1 (2分)
(5)① CO32-
+ H2O HCO3-
+ OH- 碱性溶液可除油污 (2分)
② 1010∶1 (2分)
【解析】
试题分析:(1)除杂过程中,有时为能将杂质全部除去,所用除杂试剂往往稍加过量,但过量的试剂最终要能被其他试剂所除尽。必须了解各个实验步骤的目的,才能分清操作顺序。加入过量的NaOH溶液的目的是除去Mg2+,加入过量的BaCl2溶液是为了除去SO42-,加入过量的Na2CO3溶液是为了除去Ca2+及多余的Ba2+,然后进行过滤,除去Mg(OH)2、BaSO4、CaCO3、BaCO3等难溶物,然后加适量的盐酸,除去多余的Na2CO3和调节溶液的pH。综上所述,正确的实验操作顺序为adbc或dabc;还缺少的操作步骤是过滤和蒸发结晶。
(2)盐酸与NaOH和Na2CO3反应,离子方程式为:H+ + OH- = H2O,CO32- + 2H+ = CO2↑+ H2O。
(3)电解解氯化钠溶液反应的离子方程式为:2Cl‾+2H2O  2OH‾+H2↑+Cl2↑根据总反应当两极上共收集到0.448L即0.02 mol气体时,则生成的氯气和氢气均是0.01mol,所以生成氢氧化钠的物质的量是0.02mol,所以氢氧化钠的浓度C=0.02mol÷0.2L=0.1mol•L‾1,所以pH=13。
2OH‾+H2↑+Cl2↑根据总反应当两极上共收集到0.448L即0.02 mol气体时,则生成的氯气和氢气均是0.01mol,所以生成氢氧化钠的物质的量是0.02mol,所以氢氧化钠的浓度C=0.02mol÷0.2L=0.1mol•L‾1,所以pH=13。
(4)分离出NaHCO3晶体后的母液含NH4Cl,加入过量生石灰,NH4Cl与Ca(OH)2反应获得的可以循环使用的物质为NH3。
(5)①Na2CO3为强碱弱酸盐,水解显碱性,离子方程式为:CO32- + H2O
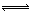 HCO3- + OH-
,碱性溶液可除油污。
HCO3- + OH-
,碱性溶液可除油污。
②反应前的溶液中水电离出的c(OH-)=1.0×10-14÷10-11=1.0×10-3mol/L,反应后溶液为pH=13,水电离出的c(OH-)=1.0×10-13mol/L,所以比值为1.0×10-3mol•L‾1:1.0×10-13mol•L‾1=1010∶1。
考点:本题考查粗盐的提纯、离子方程式的书写、电解原理、除杂和物质的判断、离子浓度和pH的计算。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
 HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的 HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的查看答案和解析>>
科目:高中化学 来源: 题型:

| O | 2- 4 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com