
(10分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
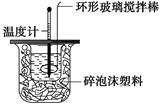
 温度 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
44.Ⅰ.(1)5.0(2)abe
Ⅱ.(1)H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l)ΔH=-114.6 kJ·mol-1
(2)①4.0②-53.5 kJ·mol-1③acd
解析试题分析:(1)245ml的溶液,需要配制250ml的溶液,故需要根据体积250mL算出所需氢氧化钠的质量;(2)氢氧化钠需放到小烧杯中称量,故用到天平、小烧杯和钥匙;II(1)中和热是指生成1molH2O放出的热量,故生成2molH2O时放出的热量也加倍;(2)①终止温度减去起始温度平均值,算出每次的温度差,再求四次的平均值;②比热容乘以溶液的质量得热量,再算出生成1mol水放出的热量换算成kJ即得中和热;③b选项量取氢氧化钠时仰视读数会使所取氢氧化钠体积增大,放出热量增多,故b错误;ac均是热量有损失,故正确;d是温度计上附着的氢氧化钠和硫酸反应了,这部分热量损失了;故选acd。
考点:中和热的定义、氢氧化钠溶液的配制、中和热的测量、误差分析等知识。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:填空题
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)已知滤液B的主要成份是硝酸铵,则酸X为_______(填名称,下同),A物质为_______。
(2) 检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
(3) 写出加入碳酸铵所发生反应的离子方程式: 。
写出加入碳酸铵所发生反应的离子方程式: 。
(4) CaO2可作供氧剂,写出CaO2与水反应的化学方程式:____________。
(5)CaO2中一般含CaO,某探究小组按下列过程测量CaO2含量:首先称取0.80g样品,然后将样品溶于100mL 1.0mol/L的盐酸中,收集到的气体在标准状况下的体积为112mL,则该样品中CaO2含量为___________。
(6)要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为______mL;配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
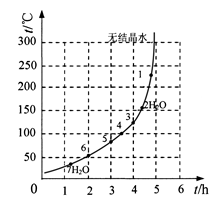
(6)下表和下图为“烘干粉碎”的试验结果。
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气(K2Cr2O7被还原为Cr3+)。
(1)K2Cr2O7与浓盐酸反应的化学方程式为_______;若反应中转移3 mol e-,则消耗_______mol K2Cr2O7
(2)稀盐酸与K2Cr2O7固体混合加热没有氯气生成。为探究影响氯气生成的因素,某化学兴趣小组进行如下实验:
①提出假设
假设1:Cl-浓度对反应有影响;
假设2:H+浓度对反应有影响;
假设3: _____________________。
②设计实验方案,进行实验。写出实验步骤及预期现象和结论。
限选举实验试剂:浓盐酸、稀盐酸、浓硫酸、NaOH溶液、K2Cr2O7固体、NaCl固体、湿润的淀粉KI试纸
| 实验步骤 | 预期现象和结论 |
| 步:1:向盛有K2Cr2O7固体的A、B两试管中分别加入一定量的稀盐酸。 | |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(4分)下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大 |
| B.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)近年来我国的航天事业取得了巨大的成就,在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1 g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116 ℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.冷凝管 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定某铝镁合金中镁的质量分数,某小组计划将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。填写下列空白。
(1)同学们选用甲装置进行实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因是________________。
(2)同学们经讨论认为甲装置有两个方面会引起较大误差,分别是__________和__________。
(3)于是他们设计了实验装置乙。乙中导管a的作用是__________。若实验前后滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为______mL。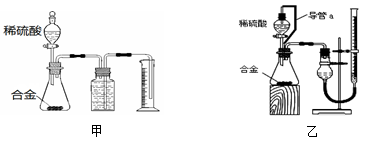
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
[规格]每片含琥珀酸亚铁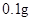 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 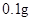 /日,成人治疗量 /日,成人治疗量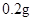 — —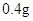 /日。 /日。小儿用量预防量 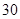 — —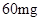 /日,治疗量 /日,治疗量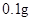 — —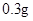 /日 /日[贮藏]避光、密封、在干燥处保存。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com