

 .
. .
.分析 (1)主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,据此判断这几种元素在周期表中的位置;
(2)S2-核外有3个电子层、最外层电子数是8,据此书写其离子结构示意图;
(3)同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,所以原子半径最大的元素处于周期表左下角(稀有气体除外);
(4)元素的非金属性越弱,其最高价氧化物的水化物酸性越弱;元素最高价氧化物的水化物呈两性的是氢氧化铝;
(5)钠离子和氧离子之间以离子键结合形成离子化合物;
(6)Al的最高价氧化物的水化物是氢氧化铝,属于两性氢氧化物,S元素的最高价氧化物的水化物是硫酸,氢氧化铝和硫酸反应生成硫酸铝和水;
(7)同一周期元素,元素的金属性随着原子序数增大而减弱,可以根据金属之间的置换反应、金属与水或酸反应生成氢气的难易、其最高价氧化物的水化物碱性强弱判断金属性强弱.
解答 解:(1)主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,H原子有一个电子层、最外层电子数是1,所以位于第一周期第IA族;
Na原子核外有三个电子层、最外层电子数是1,所以位于第三周期第IA族;
Al原子核外有三个电子层、最外层电子数是3,所以位于第三周期第IIIA族;
O原子核外有2个电子层、最外层电子数是6,位于第二周期第VIA族;
S原子核外有3个电子层、最外层电子数是6,位于第三周期第VIA族;
Cl原子核外有3个电子层、最外层电子数是7,位于第三周期第VIIA族;
即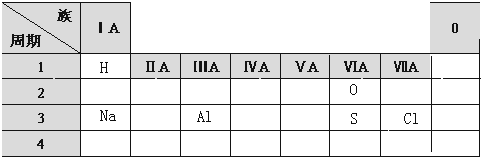 ,
,
故答案为: ;
;
(2)S2-核外有3个电子层、最外层电子数是8,质子数是17,所以其离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,所以原子半径最大的元素处于周期表左下角(稀有气体除外),所以这几种元素中原子半径最大的是Na,故答案为:Na;
(4)元素的非金属性越弱,其最高价氧化物的水化物酸性越弱,这几种元素的最高价氧化物的水化物酸性最弱的是H2SO4;元素最高价氧化物的水化物呈两性的是Al(OH)3,
故答案为:H2SO4;Al(OH)3;
(5)钠离子和氧离子之间以离子键结合形成离子化合物,其电子式为 ,故答案为:
,故答案为: ;
;
(6)Al的最高价氧化物的水化物是氢氧化铝,属于两性氢氧化物,S元素的最高价氧化物的水化物是硫酸,氢氧化铝和硫酸反应生成硫酸铝和水,离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(7)同一周期元素,元素的金属性随着原子序数增大而减弱,所以金属性较强的是Na;可以根据金属之间的置换反应、金属与水或酸反应生成氢气的难易、其最高价氧化物的水化物碱性强弱判断金属性强弱,钠和冷水反应而铝和冷水不反应,故答案为:Na;钠能与冷水反应(只要合理均可).
点评 本题考查元素周期表和元素周期律,明确元素周期表结构、物质结构、原子结构、元素周期律即可解答,知道氢氧化铝的两性,知道金属的金属性强弱判断方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 干冰升华--共价键 | B. | 二氧化硅熔融--分子间作用力 | ||
| C. | 氢氧化钠熔融--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与苯分别受热变为气体 | B. | 氯化钠与氯化氢分别溶解在水中 | ||
| C. | 碘与干冰分别受热变为气体 | D. | NaHSO4受热熔化与溶于水变为溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
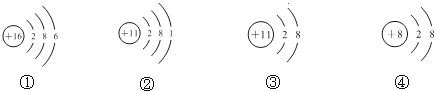
| A. | 它们表示三种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
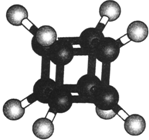
| A. | 它在核磁共振氢谱中只出现一个峰 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它不易燃烧 | |
| D. | 它与苯乙烯(C6H5-CH═CH2)不是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 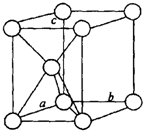 | (1)镁原子在二维空间的配位数为6 |
| (2)位于晶胞中部的鎂原子与离它最近两平面相切(填“相离”或“相切”或”相交”) | |
| (3)请用含R1、NA的数学式子表达金属镁的密度:$\frac{3\sqrt{2}}{{{R}_{1}}^{3}{N}_{A}}$g/cm3(根号带在分子上) | |
 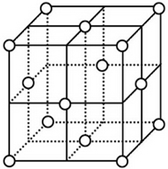 | (4)铜原子在三维空间的配位数为12 |
| (5)晶胞中面心上的六个铜原子构成的空间几何体名称为正八面体 | |
| (6)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}{{•R}_{2}}^{3}}$g/cm3(根号带在分子上) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
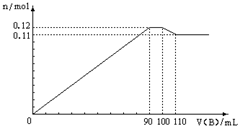 向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com