
【题目】已知空气-锌电池的电极反应为:锌片:Zn+20H--2e-=ZnO+H20 石墨:02+2H20+4e-=40H-根据此判断,锌片是
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原、
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】实验室用粗铜(含杂质Fe)制备氯化铜。
(1)采用如下图所示的装置进行实验(部分仪器和夹持、加热装置已略去)。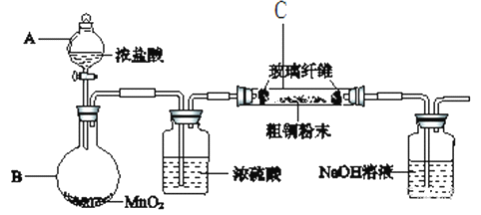
①仪器A的名称是________________;
②实验开始前,需要做的操作是____________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为______(填“是”或“否”)必需。原因_______________________________________。
④实验过程中,装置C内的现象是___________________________________。
⑤氢氧化钠溶液的作用是______________________________,其中发生反应的主要离子方程式___________________________、________________________。
(2)若将C中所得固体加稀硫酸溶解。取少量溶液于小试管中,滴加2滴KSCN溶液,无现象。请用必要的文字和离子方程式解释出现这一现象的原因_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列反应回答相应问题.
①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
未被还原的硝酸与参加反应的总硝酸的质量比为 .
②S+2KNO3+3C ![]() K2S+N2↑+3CO2↑ 还原剂是还原产物是
K2S+N2↑+3CO2↑ 还原剂是还原产物是
③3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O 反应中若消耗3molCl2共转移mol电子.
5NaCl+NaClO3+3H2O 反应中若消耗3molCl2共转移mol电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
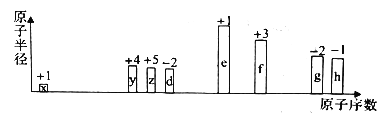
A. 离子半径的大小顺序:d
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应时的步骤如下:

(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g氢氧化钠、5 mL 水和10 mL酒精,加入酒精的作用是________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得到的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,液体分为上下两层,肥皂在________层,这个操作称为________。
(4)图中长玻璃导管的作用为________________________。
(5)写出该反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:______________________________________,该过程中调节溶液的pH为5,则c(Fe3+)为:____________mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
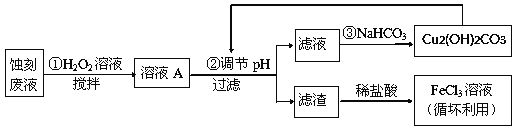
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:_______________。
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:_________________。
③步骤①中加入H2O2溶液的目的是:______________________________________。
④已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是:________________。
⑤写出步骤②中生成CO2的离子方程式:__________(已知Cu2(OH)2CO3难溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度均为0.100mol/L的下列物质的溶液中,c(NH4+)最大的是( )
A.NH4ClB.NH4HSO4C.NH3·H2OD.CH3COONH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:
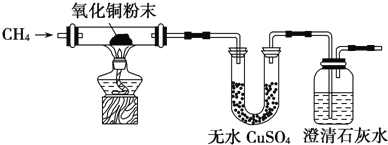
(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为________________________________;
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是___________________;请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI+5KIO3+3H2S=3I2+3K2SO4+3H2O,下列说法正确的是( )
A.氧化剂和还原剂物质的量之比为5:4
B.3 mol H2S可还原4mol的KIO3
C.I2是还原产物,K2SO4是氧化产物
D.1molKIO3可氧化0.2mol的KI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com