
【题目】实验室用粗铜(含杂质Fe)制备氯化铜。
(1)采用如下图所示的装置进行实验(部分仪器和夹持、加热装置已略去)。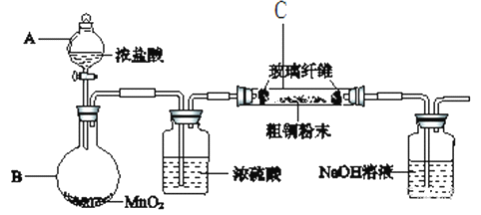
①仪器A的名称是________________;
②实验开始前,需要做的操作是____________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为______(填“是”或“否”)必需。原因_______________________________________。
④实验过程中,装置C内的现象是___________________________________。
⑤氢氧化钠溶液的作用是______________________________,其中发生反应的主要离子方程式___________________________、________________________。
(2)若将C中所得固体加稀硫酸溶解。取少量溶液于小试管中,滴加2滴KSCN溶液,无现象。请用必要的文字和离子方程式解释出现这一现象的原因_________________。
【答案】 分液漏斗 检验装置气密性 否 HCl对该反应无影响(或合理解释) 铜粉红热,产生棕黄色的烟,放出热量 吸收未反应的氯气和氯化氢气体,保护环境(或合理解释) Cl2+2OH-=Cl-+ClO-+H2O H++OH-=H2O 装置C中生成的氯化铁被未反应的铜还原成氯化亚铁,2Fe3++Cu=2Fe2++Cu2+
【解析】(1)①根据图示,仪器A为分液漏斗,故答案为:分液漏斗;
②该实验过程中涉及到气体的制备,因此实验开始前,需要进行的操作是检验装置气密性,故答案为:检验装置气密性;
③HCl对该反应无影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,故答案为:否;HCl对该反应无影响;
④实验过程中,装置C中氯气与铜反应,铜粉红热,产生棕黄色的烟,放出热量,故答案为:铜粉红热,产生棕黄色的烟,放出热量;
⑤氯气和氯化氢会污染空气,因此需要用氢氧化钠溶液吸收未反应的氯气和氯化氢气体,其中发生反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,故答案为:吸收未反应的氯气和氯化氢气体,防止污染环境;Cl2+2OH-=Cl-+ClO-+H2O;H++OH-=H2O;
(2)装置C中生成的氯化铁被未反应的铜还原成了氯化亚铁,2Fe3++Cu=2Fe2++Cu2+,因此滴加2滴KSCN溶液,无现象,故答案为:装置C中生成的氯化铁被未反应的铜还原成氯化亚铁,2Fe3++Cu=2Fe2++Cu2+。


科目:高中化学 来源: 题型:
【题目】下列反应中,被还原的物质和被氧化的物质的物质的量之比最大的是
A. 铜和稀硝酸3Cu+8HNO3(稀)=2NO↑+3Cu(NO3)2+4H2O
B. 二氧化锰和浓盐酸 MnO2+4HC1(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C. 二氧化氮和水3NO2+H2O=2HNO3+NO
D. 氯气和氨气3Cl2+8NH3=N2+6NH4C1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W的最简单氢化物甲是一种能使湿润的红色石蕊试纸变蓝的无色气体,常用作制冷剂,Y的金属性是所有短周期主族元素中最强的,Z与X属于同一主族,Z与Y属于同一周期。
(1)元素W在周期表位置_______________;
(2)元素W的另一常见氢化物乙是一种高能燃料,为18电子微粒,乙的结构式为___________;
(3)X、Y、Z的原子半径由小到大为______________________;
(4)若X与Z的最外层电子数之和是W核外电子数的2倍,甲可与Z单质发生置换反应,产物之一可作化肥,其反应的化学方程式为_______________,该产物化肥中含有的化学键有______________________。
(5)若由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。则元素Z是____元素,反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
A. 47 B. 57
C. 61 D. 175
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的判断正确的是( )
A. 60℃时,NaCl溶液的pH<7,则溶液呈酸性
B. 将pH=4的CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小
C. 常温下,CH3COOH分子可能存在于pH>7的碱性溶液中
D. 相同温度下,1 mol·L-1氨水与0.5 mol·L-1氨水中c(OH-)之比是2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式为3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A.反应中MnO2是氧化剂
B.该反应属于复分解反应
C.KClO3在反应中失去电子
D.反应中每生成l mol K2MnO4 , 氧化剂得到2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为:锌片:Zn+20H--2e-=ZnO+H20 石墨:02+2H20+4e-=40H-根据此判断,锌片是
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com