
����Ŀ���������ƣ�NaClO2���Ƕ������ȣ�ClO2������Ƭ����Ҫ�ɷ֡�ʵ�����������ƣ�NaClO3��Ϊԭ�����Ƶ�ClO2�����Ʊ�NaClO2�ֲ�Ʒ����������ͼ��
��֪����ClO2�ɱ�NaOH��Һ���գ���ӦΪ2ClO2+2NaOH=NaClO3+NaClO2+H2O��
����ˮNaClO2�����ȶ�����ˮ����ʱ�����ֽ⡣
��1����Ӧ����������XΪSO2������Ʊ�ClO2��Ӧ�����ӷ���ʽΪ___��
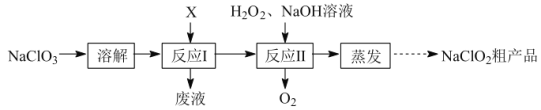
��2��ʵ������ͼ-1��ʾ��װ���н��С�
����XΪ�����Ũ���ᣬҲ�ɷ�Ӧ����ClO2���÷�Ӧ�Ͼ��ҡ����÷�Ӧ��װ��A��������ƿ�н��У��������Լ���a.Ũ���b.��ƣ�c.NaClO3��Һ��������������ƿ��˳������Ϊ___������ĸ����
�ڷ�Ӧ����˫��ˮ��������___�����ַ�Ӧʱ�䡢��Ӧ����ܼ����������䣬ʵ�������ClO2�����ʵIJ����У�װ��A�з���������ơ�___��д��һ�ּ��ɣ���
��3����װ��B����Һ����������NaClO2�������������˿��Ƶ�����Ϊ___��������ѹ��������ѹ��������ѹ������
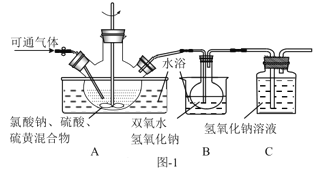
��4����Ӧ�����÷�Һ����Ҫ����ΪNa2SO4��NaHSO4��ֱ���ŷŻ���Ⱦ�������˷���Դ��Ϊ���л��â����Na2SO4��10H2O����ʯ�ࣨˮ������ƣ����벹������ʵ�鷽����___������Һ��һ���������ŷţ�ʵ������ʹ�õ��Լ����豸�У�CaO���塢��̪����ˮ�ͱ�ˮԡ������֪��CaSO4������Na2SO4ˮ��Һ��Na2SO4���ܽ��������ͼ2��ʾ��
���𰸡�2ClO3-+SO2�T2ClO2+SO42- cab ����ԭ�� ˮԡ����ʱ�����¶Ȳ��ܹ��ߣ����һ��������ݵȣ� ��ѹ ���Һ�з�����������CaO���岢���裬�ñ�ˮԡ���Ʒ�Ӧ�¶ȣ�����Һȡ�����μӷ�̪������Һ��dz��ɫʱֹͣ����CaO�����ú���ˣ���ˮϴ�ӳ���2-3�εõ�ʯ�ࣻ��Һ����Ũ������ȴ�ᾧ��32.4�����£��ӽ�0�棬���ˣ����þ����ñ�ˮϴ��2-3�Σ����¸���õ�â��
��������
�ö�������NaClO3��ԭ�Ƶ�ClO2��ClO2��NaOH��Ӧ�Ƶ�NaClO3��NaClO2�����ù������⽫NaClO3��ԭ��NaClO2�Ƶ�NaClO2��Ʒ��
��1��SO2����ԭ����S���ϼ�����2����������SO42-��ClO3-��������������ԭ��ClO2��Cl���ϼ۽���1����ϵ��ӵ�ʧ�غ㡢����غ㡢ԭ���غ����д���ӷ���ʽ��2ClO3-+SO2�T2ClO2+SO42-���ʴ�Ϊ��2ClO3-+SO2�T2ClO2+SO42-��
��2���ٷ�Ӧ���ң�Ũ����ֻ����������ӣ��������ͼ��֪�ȼ�NaClO3������˳��Ϊ���ȼ�NaClO3���ټ�S������Ũ���ᣬ�ʴ�Ϊ��cab��
�ڷ�Ӧ����NaOH��ClO2��Ӧ����NaClO3��NaClO2����������������ǽ�NaClO3��ԭ��NaClO2�����������ֽ⣬�¶Ȳ���̫�ߣ����Կ���A��ˮԡ����ʱ�¶Ȳ����ߣ�������B�н��衢����һ��������ݣ��ʴ�Ϊ������ԭ����ˮԡ����ʱ�����¶Ȳ��ܹ��ߣ����һ��������ݵȣ���
��3����ˮNaClO2�����ȶ�����ˮ����ʱ�����ֽ⣬Ӧ�ü�ѹ����ˮ�־����������ʴ�Ϊ����ѹ��
��4������һ����CaOʹNaHSO4��Ӧ��CaSO4��Ϊ�˱�֤NaHSO4��Ӧ�꣬����CaO���Թ�����CaO������Һ���Լ����ˣ������÷�̪��ָʾ��������Һ��Ϊdz��ɫʱֹͣ��CaO��CaSO4������Na2SO4ˮ��Һ����ʱ���ù��ˡ�ϴ�ӵķ����õ�ʯ�࣬��ʱ��ҺΪNa2SO4��Һ��������â������ͼ�Ͽ����ɽ��¶ȵ���32.4�����£��γ�â��������â�����壬���ˡ�ϴ�ӡ�����Ϳɵ�â���ˣ�Ϊ��ʹâ�����ʽϸߣ����ñ�ˮϴ�ӣ��������ܽ���ʧ�������ʴ�Ϊ�����Һ�з�����������CaO���岢���裬�ñ�ˮԡ���Ʒ�Ӧ�¶ȣ�����Һȡ�����μӷ�̪������Һ��dz��ɫʱֹͣ����CaO�����ú���ˣ���ˮϴ�ӳ���2-3�εõ�ʯ�ࣻ��Һ����Ũ������ȴ�ᾧ��32.4�����£��ӽ�0�棬���ˣ����þ����ñ�ˮϴ��2-3�Σ����¸���õ�â����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����;�㷺�Ļ���ԭ�ϡ���������һ�ֹ㷺���ڵ��ӹ�ҵ��ͨѶ�������Ҫ��������Ԫ��(31Ga)��Ԫ�����ڱ���λ�ڵ�������IIIA�壬��ѧ��������Ԫ�����ơ�
��1����ͼ�ǵ���Ӧ���а�n(N2):n(H2)=1:3Ͷ�Ϻ���200����400����600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�
��֪��N2(g)+3H2(g)![]() 2NH3(g) ��H<0
2NH3(g) ��H<0

������c��Ӧ���¶���_____��
�����ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ����_____������ĸ����
A����ʱ�����NH3�������H2��ƽ��ת����
B��������������ԭ����һ����ø����·�����Ӧ
C����ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)��K(Q)>K(N)
����ҵ�Ϻϳɰ��Ĵ���Ϊ����ý��ѡ���¶�Ϊ500����ԭ����______��
��2����ҵ������Ga��NH3�ϳɹ���뵼����ϵ�����(GaN)ͬʱ���������ɡ���Ӧ�У�����3molH2ʱ�ͻ�ų�30.8kJ��������
���÷�Ӧ���Ȼ�ѧ����ʽ��__________��
���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��_____��
���ں��º��ݵ��ܱ���ϵ�ڽ����������淴Ӧ�������йر�����ȷ����_____��
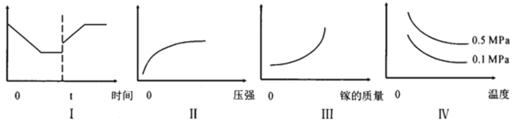
A��Iͼ�������������Ϊ����Ӧ���ʣ���tʱ�̸ı����������Ϊ����
B��IIͼ�������������Ϊ�ص�ת����
C��IIIͼ�������������Ϊ��ѧ��Ӧ����
D����ͼ�������������Ϊ��ϵ�ڻ������ƽ����Է�������
��������(GaN)�����ȶ������ܻ������ܽ����ȵ�NaOH��Һ�У��÷�Ӧ�����ӷ���ʽ��________��
��3����һ�������Ͻ���ȫ�����ռ���Һ�еõ���ҺX����֪��
Al(OH)3 | Ga(OH)3 | |
��ʽ���볣��Ka | 2��10-11 | 1��10-7 |
��ʽ���볣��Kb | 1.3��10-33 | 1.4��10-34 |
��X��Һ�л���ͨ��CO2����������������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���仯�������;�㷺��̼Ԫ�ز������γɷḻ��ʵ��л�������,���һ����γɶ����������ͬʱ���������γɶ��ֵ��ʡ�
(1)C60�����γɵľ����У��ھ����Ķ�������ľ�����һ��C60���ӣ���һ��C60����������Ϊ____��
(2)�ɱ��ͱ������ֳ����ķ��Ӿ��壬���й������־���ıȽ�����ȷ����____��
a.��������ܶȣ��ɱ�>�� b.��������۵㣺�ɱ�>��
c.�������еĿռ������ʣ��ɱ�>�� d.�������з��Ӽ��������������ͬ
(3)���ʯ��ʯī��̼Ԫ���γɵ����ֳ������ʣ����й��������ֵ��ʵ���������ȷ����____��
a.�����ʯ��̼ԭ�ӵ��ӻ�����Ϊsp3�ӻ���ʯī��̼ԭ�ӵ��ӻ�����Ϊsp2�ӻ�
b.�������й��ۼ��ļ��������ʯ��C��C<ʯī��C��C
c.��������۵㣺���ʯ>ʯī
d.�������й��ۼ��ļ��ǣ����ʯ>ʯī
e.�����ʯ������ֻ���ڹ��ۼ���ʯī����������ڹ��ۼ����������ͷ��»���
f.�����ʯ��ʯī���۵㶼�ܸߣ����Խ��ʯ��ʯī����ԭ�Ӿ���
(4)���ʯ�����ṹ��ͼ��ʾ������BN�ṹ����ʯ���ƣ���BN�����У�Bԭ����Χ�����Nԭ�������ɵ�����ͼ��Ϊ____��һ��������Nԭ����ĿΪ____��
(5)̼���ȸʯ���ȿ��Եõ�����ͭ������ͭ���������������ܶѻ������ھ����Ķ�������ľ�����һ��Cuԭ�ӣ���Cu������Cuԭ�ӵ���λ��Ϊ___����֪Cu������ܶ�Ϊ�� g��cm-3��Cu�����ԭ������ΪM�������ӵ�����ΪNA����Cu��ԭ�Ӱ뾶Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�����ҵ�Ͷ�������ڽ������������ǧ��������Һ����ش���ʾ����վ��������Һ������ܷ�ӦΪFe3++Cr2+![]() Fe2++Cr3+������ʾ��ͼ��ͼ������˵���������
Fe2++Cr3+������ʾ��ͼ��ͼ������˵���������

A.�ŵ�ʱa�缫��ӦΪFe 3++e=Fe2+
B.���ʱb�缫��ӦΪCr3++e=Cr2+
C.�ŵ������H+ͨ����Ĥ��������������
D.�õ���ޱ�ը���ܣ���ȫ�Ըߣ����Ժ�ʴ����Խϵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������ͼ��ʾװ����ȡ��������ˮ![]() ���Իش��������⣺
���Իش��������⣺
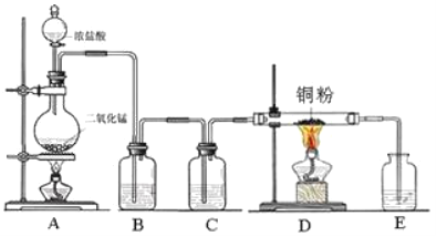
(1)д����ƿ�з�����Ӧ�Ļ�ѧ����ʽ������˫���ű������ת�Ƶķ������Ŀ______________��
(2)B��ʢ�б���ʳ��ˮ��������______________��
(3)C��ʢ�ŵ��Լ�__________�������ƣ�����������______________��
(4)E��ʢ��___________�������ƣ�����������______________��������Ӧ�����ӷ���ʽΪ___________________��
(5)ʵ�鿪ʼʱ��Ӧ�ȵ�ȼ__________��������ĸ����ͬ���ƾ��ƣ�ʵ�����ʱ��Ӧ��Ϩ��__________���ƾ��ơ�
(6)D��������Ӧ�Ļ�ѧ����ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A.��������(C3H3N3O3)�ĽṹʽΪ �������ڹ��ۻ�����
�������ڹ��ۻ�����
B.ֻ��H��N��O����Ԫ�صĻ�������������ӻ����Ҳ�����ǹ��ۻ�����
C.NaHCO3��HCOONa���������Ӽ����ۼ�
D.������MgO��SiO2��SO3�л�ѧ����������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����������ʵ��ij���װ�ã������й�ʵ�������˵������ȷ����

A.��ˮ������ˮ���Թ�����NO2���ɿ���Һ��������������һ������O2��ʹҺ����������Թ�
B.��ˮ������NaOH��Һ���Թ�����Cl2���ɿ���Һ���������Թ��л���ɫ��ȥ
C.��ˮ������ˮ�����м�����ɫʯ��Թ�����SO2���ɿ���Һ����������Ϊ��ɫ
D.��ˮ������ˮ�����м��η�̪���Թ�����NH3���ɿ���Һ���������ʺ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[ѡ��5�����л���ѧ����] �ϳ���ά��Ŀǰ����ռ��һλ���Ǿ�����ά�������ڡ�
�����Ǿ۶Ա��������Ҷ���������Ʒ������ṹΪ��
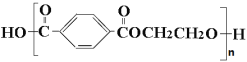
���ڵ�һ�ֺϳ�·�����£�
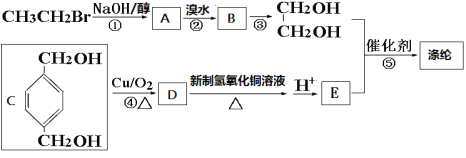
��1��A�й����ŵĽṹʽΪ_____________����Ӧ�١��ڵķ�Ӧ���ͷֱ�Ϊ_________��_________���л���B��������______________________����Ӧ�ۿ��õ��Լ�Ϊ___________________��
��2��д����Ӧ�ݵĻ�ѧ����ʽ��_______________��
��3��1 mol D������������Һ��Ӧ�ɵõ�____________mol�����ʡ�
��4��д���л���C��ͬ���칹���У����б�������ͬʱ�������������������л���Ľṹ��ʽ��______________��
a �ܷ�����ȥ��Ӧ b ����Ũ��ˮ��Ӧ���ɰ�ɫ���� c �˴Ź���������6����
��5����ҵ�ϳ�����Fֱ����������ȡ�л���E����֪��F�ķ���ʽΪC8H10������ṹ��ʽΪ________________��F��һ��ͬϵ��G��F��2��̼ԭ�ӣ����б�����ֻ��һ��ȡ������G�Ľṹ��____________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ���ֱ���10 mLŨ�Ⱦ�Ϊ0.1 mol��L��1��CuCl2��ZnCl2��Һ�еμ�0.1 mol��L��1��Na2S��Һ���μӹ����У�lgc(Cu2��)�ͣ�lgc(Zn2��)��Na2S��Һ���(V)�Ĺ�ϵ��ͼ��ʾ[��֪��Ksp(ZnS)��Ksp(CuS)��lg3��0.5]�������й�˵���������(����)��
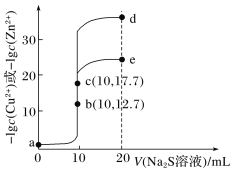
A.a��b��dΪ�ζ�ZnCl2��Һ������
B.��Ӧ��ҺpH��a��b��e
C.a���Ӧ��CuCl2��Һ�У�c(Cl��)��2[c(Cu2��)��c(H��)]
D.d��������ԼΪ33.9
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com