
【题目】T℃时,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg3≈0.5]。下列有关说法错误的是( )。
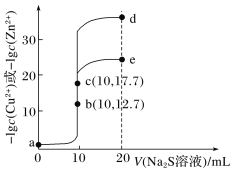
A.a~b~d为滴定ZnCl2溶液的曲线
B.对应溶液pH:a<b<e
C.a点对应的CuCl2溶液中:c(Cl-)<2[c(Cu2+)+c(H+)]
D.d点纵坐标约为33.9
【答案】A
【解析】
A.10mL浓度为0.1 molL1的CuCl2和ZnCl2溶液中滴入10mL0.1 molL1的Na2S反应生成CuS沉淀和ZnS沉淀,Ksp(ZnS)> Ksp(CuS),反应后溶液中锌离子浓度大,则abe为滴定ZnCl2溶液的曲线,故A错误;
B.某温度下,分别向10mL浓度均为0.1 molL1的CuCl2和ZnCl2溶液中滴加0.1 molL1的Na2S溶液发生反应生成硫化铜和硫化锌,铜离子浓度和锌离子浓度减小,水解产生的c(H+)降低,溶液pH增大,硫化钠溶液呈碱性,完全反应后继续滴加硫化钠溶液,溶液pH增大,溶液pH:a<b<e,故B正确;
C.CuCl2在溶液中发生水解反应,生成氢氧化铜,溶液中存在物料守恒:c(Cl)= 2c(Cu2+) + 2c[Cu(OH)2],溶液中氢离子浓度大于氢氧化铜的浓度,c(Cl)<2[c(Cu2+)+c(H+)],故C正确;
D.c点时铜离子全部沉淀,此时加入的Na2S的物质的量等于原溶液中CuCl2的物质的量,所以生成CuS沉淀后,c(Cu2+)=c(S2),则Ksp(CuS)=1017.7×1017.7=1035.4,d点加入20mL0.1 molL1Na2S溶液,溶液中硫离子浓度![]() ,
,![]() ,c(Cu2+)=3×1034.4molL1,-lgc(Cu2+)=34.4-lg3= 34.4-0.5= 33.9,故D正确。
,c(Cu2+)=3×1034.4molL1,-lgc(Cu2+)=34.4-lg3= 34.4-0.5= 33.9,故D正确。
综上所述,答案为A。


科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是二氧化氯(ClO2)泡腾片的主要成分。实验室以氯酸钠(NaClO3)为原料先制得ClO2,再制备NaClO2粗产品,其流程如图:
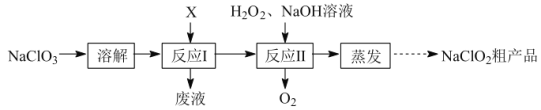
已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为___。
(2)实验在如图-1所示的装置中进行。
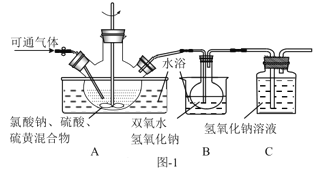
①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为___(填字母)。
②反应Ⅱ中双氧水的作用是___。保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的操作有:装置A中分批加入硫黄、___(写出一种即可)。
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为___(填“减压”、“常压”或“加压”)。
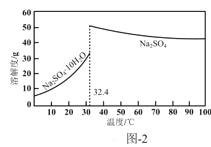
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:___,将滤液进一步处理后排放(实验中须使用的试剂和设备有:CaO固体、酚酞、冰水和冰水浴)。已知:CaSO4不溶于Na2SO4水溶液;Na2SO4的溶解度曲线如图2所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,7.84L甲烷完全燃烧后生成二氧化碳和液态水,同时放出311.4kJ的热量,则甲烷燃烧的热化学方程式是( )
A. CH4+2O2→CO2+2H2O+311.4kJ
B. CH4(g)+2O2(g)→CO2(g)+2H2O(l)+311.4kJ
C. CH4(g)+2O2(g)→CO2(g)+2H2O(l)+889.7kJ
D. CH4(g)+2O2(g)→CO2(g)+2H2O(g)+889.7kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成二甘醇的原理为:![]() +HOCH2CH2OH
+HOCH2CH2OH![]() HOCH2CH2OCH2CH2OH,下列叙述正确的是( )
HOCH2CH2OCH2CH2OH,下列叙述正确的是( )
A. 二甘醇能与氢气发生加成反应
B. 二甘醇是乙醇的同系物
C. 二甘醇是丙二醇(C3H8O2)的同分异构体
D. 二甘醇能通过脱水产生碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,改变
,改变![]() 溶液的
溶液的![]() ,溶液中
,溶液中![]() 浓度的对数值
浓度的对数值![]() 与溶液
与溶液![]() 的变化关系如图所示。若
的变化关系如图所示。若![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
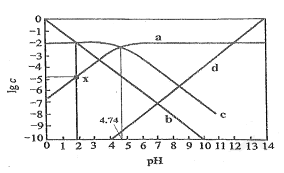
A. ![]() 时,
时,![]()
B. ![]() 电离常数的数量级为
电离常数的数量级为![]()
C. 图中点x的纵坐标值为![]()
D. ![]() 的
的![]() 约等于线c与线d交点处的横坐标值
约等于线c与线d交点处的横坐标值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+![]() O2(g) △H=+484kJ/mol
O2(g) △H=+484kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C. H2(g)+![]() O2(g)=H2O(l) △H=+242kJ/mol
O2(g)=H2O(l) △H=+242kJ/mol
D. H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________.
(2)甲同学设计如图装置用ZnCl2 xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用______________________________________;加热条件下,A装置中总的化学方程式为____________________.
②装置的连接顺序为A→B→_____________________;
③实验结束后,为检测ZnCl2 xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为_____________(填序号)
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=______________(保留小数点后一位),即可证明晶体已完全脱水.
(3)乙同学认为SOCl2还可用作由FeCl3 6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式______________________.
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加_____________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加 _____________ | __________________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20 mL 0.1000 mol·L-1 CH3COOH溶液中滴入0.1000 mol·L-1NaOH溶液,滴定曲线如图所示(忽略温度变化)。下列说法正确的是
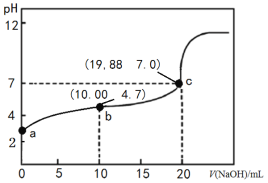
A.该滴定过程应该选择石蕊溶液做指示剂
B.由c点数值可求醋酸的电离平衡常数为1.66×10-5 mol·L-1
C.b点溶液中各微粒浓度关系为2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-)
D.中和同体积同pH的醋酸和盐酸所用氢氧化钠的物质的量,后者多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com