
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________.
(2)甲同学设计如图装置用ZnCl2 xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用______________________________________;加热条件下,A装置中总的化学方程式为____________________.
②装置的连接顺序为A→B→_____________________;
③实验结束后,为检测ZnCl2 xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为_____________(填序号)
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=______________(保留小数点后一位),即可证明晶体已完全脱水.
(3)乙同学认为SOCl2还可用作由FeCl3 6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式______________________.
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加_____________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加 _____________ | __________________ | 则没有发生上述副反应 |
【答案】2:3:1 SOCl2作脱水剂,与水反应生成HCl可以抑制氯化锌的水解 SOCl2 + ZnCl2 xH2O ![]() ZnCl2 + SO2 ↑+ 2 HCl ↑+ (x-1) H2O↑ D→E→F→C d a e f c 0.56 SOCl2 + 2Fe3+ + 3H2O == SO42- + 6H+ + 2Fe2+ + 2Cl- BaCl2溶液 K3[Fe(CN)6]溶液 若无蓝色沉淀出现
ZnCl2 + SO2 ↑+ 2 HCl ↑+ (x-1) H2O↑ D→E→F→C d a e f c 0.56 SOCl2 + 2Fe3+ + 3H2O == SO42- + 6H+ + 2Fe2+ + 2Cl- BaCl2溶液 K3[Fe(CN)6]溶液 若无蓝色沉淀出现
【解析】
(1)根据原子利用率达100%,硫黄(S)、液氯和三氧化硫为原料制SOCl2,根据原子、电子守恒完成反应方程式。由二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,选择装置的连接顺序;根据守恒判断ZnCl2 xH2O晶体是否完全脱水(ZnCl2![]() 2AgCl)。根据存在的离子选择试剂:SO42-选择稀HCl和BaCl2;Fe2+选择K3[Fe(CN)6]溶液。
2AgCl)。根据存在的离子选择试剂:SO42-选择稀HCl和BaCl2;Fe2+选择K3[Fe(CN)6]溶液。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜(SOCl2),原子利用率达100%,所以反应方程式为:2S+3Cl2+SO3= 3SOCl2则三者的物质的量比为2:3:1。
(2)①因为二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈与水反应生成HCl可以抑制氯化锌的水解;加热条件下,A装置中总的化学方程式为SOCl2 + ZnCl2 xH2O ![]() ZnCl2 + SO2 ↑+ 2 HCl ↑+ (x-1) H2O↑。答案:SOCl2作脱水剂,与水反应生成HCl可以抑制氯化锌的水解;SOCl2 + ZnCl2 xH2O
ZnCl2 + SO2 ↑+ 2 HCl ↑+ (x-1) H2O↑。答案:SOCl2作脱水剂,与水反应生成HCl可以抑制氯化锌的水解;SOCl2 + ZnCl2 xH2O ![]() ZnCl2 + SO2 ↑+ 2 HCl ↑+ (x-1) H2O↑。
ZnCl2 + SO2 ↑+ 2 HCl ↑+ (x-1) H2O↑。
②①A中SOCl2吸收结晶水生成SO2和HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中SO2和HCl,防止污染环境,E装置防倒吸,装置连接顺序为A→B→D→E→F→C 。装置的连接顺序为A→B→D→E→F→C ;答案:D→E→F→C 。
③实验结束后,为检测ZnCl2 xH2O晶体是否完全脱水的操作方法是:d.称取蒸干后的固体m克溶于水,a.加入足量硝酸酸化的硝酸银溶液,充分反应,e.过滤f.洗涤c.干燥;b.称得固体为n克,所以正确的实验顺序为d a e f c;
ZnCl2![]() 2AgCl
2AgCl
136 287
m n m/n=0.56即可证明晶体已完全脱水.
(3)①FeCl3具有强氧化性,会和SOCl2发生氧化还原反应,可能发生的副反应的离子方程式SOCl2 + 2Fe3+ + 3H2O == SO42- + 6H+ + 2Fe2+ + 2Cl-。
②要判断副反应的可能性,就是检验溶液中有SO42-和Fe2+,所以,方案一中加BaCl2溶液,如产生白色沉淀,说明发生了副反应;方案二是检验Fe2+,所以选择K3[Fe(CN)6]溶液,加入试液后若无蓝色沉淀出现,说明没有副反应发生。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知难溶于水的盐在水中存在溶解平衡:
![]()
在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP = c(Ag+)·c(Cl-)=1.8·10-10 。
若把足量AgCl分别放入① 100 mL蒸馏水,② 100 mL 0.1 mol / L NaCl溶液,③ 100 mL 0.1 mol / L AlCl3溶液,④ 100 mL 0.1 mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______>______>______>______。在0.1 mol / L AlCl3溶液中,Ag+的物质的量浓度最多为_________mol / L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.欲实现铁片镀锌,用锌作阴极
B.电解精炼铜,若转移2mol电子,阴极质量增加64g
C.硫酸工业中采用沸腾炉以增加固、气接触面积,加快反应速率
D.工业上常用电解熔融氯化钠法制备金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种酯,分子式是C14H12O2,A可以由醇B跟羧酸C发生酯化反应得到,A不能使溴的CCl4溶液褪色,氧化B可以得到C。
(1)写出A、B、C的结构简式:A、______,B、________,C、____________。
(2)写出B的两种同分异构体的结构简式,它们都可以跟NaOH反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)![]() xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
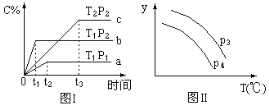
A. P3>P4,y轴表示B的转化率 B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度 D. P3>P4,y轴表示混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量,下列表示该反应的热化学方程式正确的是( )
A. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-725.76 kJ·mol-1
B. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1451.6 kJ·mol-1
C. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-22.68 kJ·mol-1
D. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mole- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为: _____________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com