
【题目】25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量,下列表示该反应的热化学方程式正确的是( )
A. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-725.76 kJ·mol-1
B. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1451.6 kJ·mol-1
C. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-22.68 kJ·mol-1
D. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
【答案】D
【解析】
1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.76 kJ,1mol甲醇燃烧放的热量为725.76 kJ,则该反应的热化学方程式为CH4O(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJmol-1或2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol,结合热化学方程式的正确书写方法判断。
O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJmol-1或2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol,结合热化学方程式的正确书写方法判断。
A. H2O的状态应为液态,A项错误;
B. 该反应为放热反应,ΔH为负值,B项错误;
C. ΔH的数值与热化学方程式的计量数不成正比,C项错误;
D. 符合题设条件,D项正确;
答案选D。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g) ![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
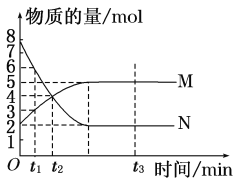
(1)此反应的化学方程式中a∶b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________________________________________________________________________。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________.
(2)甲同学设计如图装置用ZnCl2 xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用______________________________________;加热条件下,A装置中总的化学方程式为____________________.
②装置的连接顺序为A→B→_____________________;
③实验结束后,为检测ZnCl2 xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为_____________(填序号)
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=______________(保留小数点后一位),即可证明晶体已完全脱水.
(3)乙同学认为SOCl2还可用作由FeCl3 6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式______________________.
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加_____________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加 _____________ | __________________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图像,以下反应中完全符合上述图像的是( )

A. N2(g) +3H2 (g) ![]() 2NH3 (g) △H<O
2NH3 (g) △H<O
B. 2SO3 (g) ![]() 2SO2 (g) +O2 (g) △H>O
2SO2 (g) +O2 (g) △H>O
C. 4NH3 (g) +5O2 (g) ![]() 4NO (g) +6H2O (g) △H<O
4NO (g) +6H2O (g) △H<O
D. CO2(g) +NO(g) ![]() CO(g)+NO2(g) △H>O
CO(g)+NO2(g) △H>O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质及非电解质的组合完全正确的是( )
选项 | ① | ② | ③ | ④ |
强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
弱电解质 | HF | BaSO4 | HClO | CH3COOH |
非电解质 | Cl2 | CS2 | 蔗糖 | H2CO3 |
A.①B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和相同体积、相同pH值的H2SO4、HCl和CH3COOH三种稀溶液,所需相同浓度的NaOH溶液的体积为V1、V2和V3,则( )
A.V1>V2>V3B.V3>V2>V1
C.V3>V1=V2D.V1>V2=V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x取值范围________。
(3)E装置的作用是________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(5)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
A CH4 B CH3Cl C CH2Cl2 D CHCl3 E CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可大量共存且溶液无色的是( )
A. Cu2+、SO42-、Fe3+、Cl- B. Fe2+、H+、ClO-、CO32-
C. MnO4-、Al3+、Na+、SO42- D. Na+、NO3-、K+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:

(1)该图中有两处未画出,它们是______、__________。
(2)为什么所用NaOH溶液要稍过量_________________。
(3)倒入NaOH溶液的正确操作是_______________________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=______(结果保留一位小数)。
(6)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com