
【题目】下列离子可大量共存且溶液无色的是( )
A. Cu2+、SO42-、Fe3+、Cl- B. Fe2+、H+、ClO-、CO32-
C. MnO4-、Al3+、Na+、SO42- D. Na+、NO3-、K+、SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量,下列表示该反应的热化学方程式正确的是( )
A. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-725.76 kJ·mol-1
B. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1451.6 kJ·mol-1
C. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-22.68 kJ·mol-1
D. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:

已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应:
 以是烃基,也可以是H原子)
以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F。
回答下列问题:
(1)A的结构简式为 _______________,A生成B的反应类型为______________。
(2)B生成C的化学方程式为___________________。
(3)D的结构简式为_______________________,分子中最多有 _____个原子共平面。
(4)F的化学名称为_______________________。
(5)F的同分异构体中能同时满足下列条件的共有_______种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体,
②能使Br2的四氯化碳溶液褪色。其中核磁共振氢谱显示为4组峰,面积比为3 : 2 : 2 : 1的是_______(写出其中一种的结构简式)。
(6)聚乳酸 是一种生物可降解材料,参照上述信息设计由乙醇制备聚乳酸的合成路线 ___________
是一种生物可降解材料,参照上述信息设计由乙醇制备聚乳酸的合成路线 ___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温常压下,17g 甲基(-14CH3)所含的中子数为 9 NA
B. 电解精炼铜的过程中,若阳极减轻 64 g,则电路中一定通过 2NA 个电子
C. NA 个 Fe(OH)3 胶体粒子的质量为 107 g
D. 1mol 铜与足量硫蒸气反应,转移电子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mole- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为: _____________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气氢气合成氨过程中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
(1)对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是_______。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(2)利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4,同时获得副产品甲的工业生产流程如下:
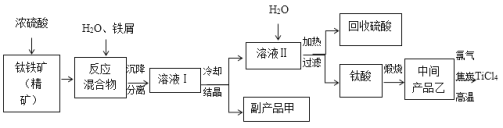
(1)已知酸浸反应FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O,则FeTiO3中铁元素的化合价为___________。
(2)上述生产流程中加入铁屑的目的是使Fe3+还原为Fe2+,且反应得到的溶液中含钛元素的离子只有TiO2+,该过程发生的主要反应有:
①2Fe3++Fe===3Fe2+ ; ②2TiO2++Fe+4H+===2Ti3++Fe2++2H2O;③______________________________________。
(3)加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________________。
(4)由TiO2·nH2O胶体制得固体TiO2·nH2O,再用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=___________________。
Fe3++3H2O的平衡常数K=___________________。
(5)可循环利用的物质是_________,副产品甲含结晶水,其化学式是_______________。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用___________方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com