
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:

(1)该图中有两处未画出,它们是______、__________。
(2)为什么所用NaOH溶液要稍过量_________________。
(3)倒入NaOH溶液的正确操作是_______________________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=______(结果保留一位小数)。
(6)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是______。
【答案】环形玻璃搅拌棒保温硬纸板确保盐酸被完全中和一次迅速倒入ΔH1=ΔH2<ΔH3-51.8 kJ·mol-1不能H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响反应的反应热
【解析】
(1)根据装置图,图中缺少环形玻璃搅拌棒和保温硬纸板,故答案为:环形玻璃搅拌棒;保温硬纸板;
(2)为了确保盐酸被完全中和,所用NaOH溶液要稍过量,故答案为:确保盐酸被完全中和;
(3)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故答案为:一次迅速倒入;
(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1molL-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1molL-1的稀盐酸恰好完全反应放热小于57.3kJ,反应焓变是负值,所以△H1=△H2<△H3;故答案为:△H1=△H2<△H3;
(5)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为:23.6℃,反应前后温度差为:3.05℃;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×![]() =12958J=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×
=12958J=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×![]() =51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
(6)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故答案为:不能;H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热。


科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量,下列表示该反应的热化学方程式正确的是( )
A. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-725.76 kJ·mol-1
B. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1451.6 kJ·mol-1
C. 2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-22.68 kJ·mol-1
D. CH4O(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mole- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为: _____________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气氢气合成氨过程中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
(1)对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是_______。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(2)利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血液中的葡萄糖称为血糖,空腹血糖是筛査糖尿病的常用指标,正常范围在3.9-6.1mmol/L(注:1m mol/L= 1×10-3 mol/L);该体检指标表示的是
A.物质的量(n)B.物质的量浓度(c)C.质量分数(ω)D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律产生的根本原因就是随着元素原子序数的递增
A. 元素的相对原子质量逐渐增大
B. 核外电子排布呈周期性变化
C. 原子半径呈周期性变化
D. 元素主要化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于pH变化的判断正确的是( )
A.温度升高,Na2CO3溶液pH减小B.温度升高,纯水pH增大
C.新制氯水经光照一段时间后,溶液pH减小D.氢氧化钠溶液久置于空气中,溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4,同时获得副产品甲的工业生产流程如下:
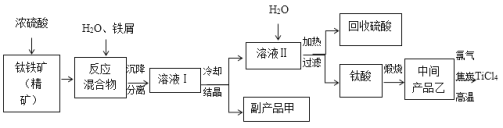
(1)已知酸浸反应FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O,则FeTiO3中铁元素的化合价为___________。
(2)上述生产流程中加入铁屑的目的是使Fe3+还原为Fe2+,且反应得到的溶液中含钛元素的离子只有TiO2+,该过程发生的主要反应有:
①2Fe3++Fe===3Fe2+ ; ②2TiO2++Fe+4H+===2Ti3++Fe2++2H2O;③______________________________________。
(3)加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________________。
(4)由TiO2·nH2O胶体制得固体TiO2·nH2O,再用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=___________________。
Fe3++3H2O的平衡常数K=___________________。
(5)可循环利用的物质是_________,副产品甲含结晶水,其化学式是_______________。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用___________方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. 162g淀粉和纤维素混合物中氧原子的数目为5NA
B. 常温时,pH=5的盐酸中水电离的OH-数目为10-9NA
C. 5mol的CH3COONa固体溶于水所得溶液中CH3COO-数目为5NA
D. 22.4L Cl2与足量的铁反应,转移的电子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com