
【题目】已知难溶于水的盐在水中存在溶解平衡:
![]()
在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP = c(Ag+)·c(Cl-)=1.8·10-10 。
若把足量AgCl分别放入① 100 mL蒸馏水,② 100 mL 0.1 mol / L NaCl溶液,③ 100 mL 0.1 mol / L AlCl3溶液,④ 100 mL 0.1 mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______>______>______>______。在0.1 mol / L AlCl3溶液中,Ag+的物质的量浓度最多为_________mol / L。
【答案】①>②>④>③、6╳ 10-10
【解析】
①100mL蒸馏水中银离子浓度不变;②100mL 0.1mol/L NaCl溶液中C(Cl-)=0.1mol/L;氯离子抑制氯化银的溶解,KSP=c(Ag+)c(Cl-)=1.8×10-10;c(Ag+)=![]() =1.8×10-9mol/L;③100mL 0.1mol/L AlCl3溶液中c(Cl-)=0.3mol/L;氯离子抑制氯化银的溶解,KSP=c(Ag+)c(Cl-)=1.8×10-10;c(Ag+)=
=1.8×10-9mol/L;③100mL 0.1mol/L AlCl3溶液中c(Cl-)=0.3mol/L;氯离子抑制氯化银的溶解,KSP=c(Ag+)c(Cl-)=1.8×10-10;c(Ag+)=![]() =6×10-10mol/L;④100mL 0.1mol/L MgCl2溶液中,C(Cl-)=0.2mol/L;氯离子抑制氯化银的溶解,KSP=c(Ag+)c(Cl-)=1.8×10-10;c(Ag+)=
=6×10-10mol/L;④100mL 0.1mol/L MgCl2溶液中,C(Cl-)=0.2mol/L;氯离子抑制氯化银的溶解,KSP=c(Ag+)c(Cl-)=1.8×10-10;c(Ag+)=![]() =9×10-10mol/L;综合上述计算得到:①>②>④>③;在0.1mol/L AlCl3溶液中,Ag+的物质的量浓度最多为:6×10-10mol/L。
=9×10-10mol/L;综合上述计算得到:①>②>④>③;在0.1mol/L AlCl3溶液中,Ag+的物质的量浓度最多为:6×10-10mol/L。


科目:高中化学 来源: 题型:
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
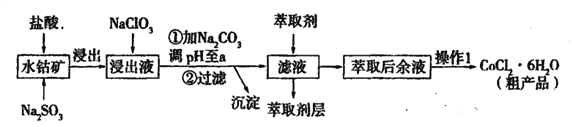
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=12的无色溶液中能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-B.Ba2+、K+、OH-、 NO3-
C.Al3+、Cu2+、SO42-、Cl-D.Na+、Ca2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A. CH2=CHCOOH和油酸 B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
(1)互为同位素的是________;
(2)互为同系物的是________;
(3)互为同素异形体的是________;
(4)互为同分异构体的是________;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质对应的化学式错误的是
A.偏铝酸钡 Ba(AlO2)2B.明矾 KAl(SO4)2·12H2O
C.醋酸钙 (CH3COO)2CaD.亚硫酸氢钙 CaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
第2周期 | ① | ② | ||||||
第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑥的原子结构示意图___________;写出⑤的氧化物的一种用途__________。
(2)表中⑤和⑥气态氢化物的稳定性顺序为 ______ >______(填氢化物的化学式);
(3)表中能形成两性氢氧化物的元素是_________(填元素符号),该元素的单质与③的氢氧化物水溶液反应的离子反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 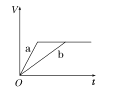 B.
B. 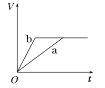 C.
C. 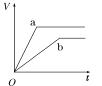 D.
D. 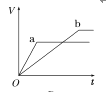
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g) ![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
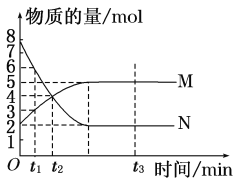
(1)此反应的化学方程式中a∶b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________________________________________________________________________。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________.
(2)甲同学设计如图装置用ZnCl2 xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用______________________________________;加热条件下,A装置中总的化学方程式为____________________.
②装置的连接顺序为A→B→_____________________;
③实验结束后,为检测ZnCl2 xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为_____________(填序号)
a.加入足量硝酸酸化的硝酸银溶液,充分反应; b.称得固体为n克; c.干燥;d.称取蒸干后的固体m克溶于水;e.过滤;f.洗涤
若m/n=______________(保留小数点后一位),即可证明晶体已完全脱水.
(3)乙同学认为SOCl2还可用作由FeCl3 6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式______________________.
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3 6H2O于试管中,加入足量SOCl2,振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加_____________ | 若有白色沉淀生成 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加 _____________ | __________________ | 则没有发生上述副反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com