
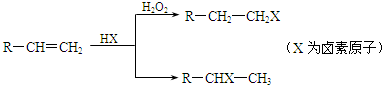
| H2O2 |
| H2O2 |
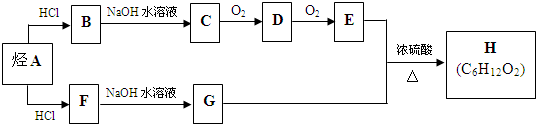
| Cu |
| △ |
| Cu |
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
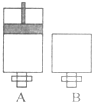 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
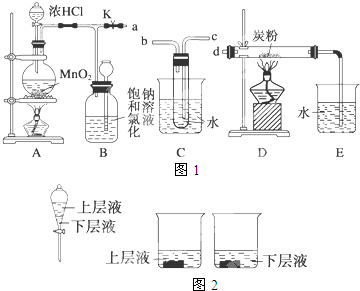
查看答案和解析>>
科目:高中化学 来源: 题型:
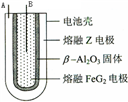
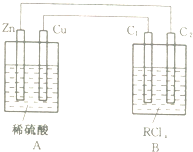 某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.
某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:
| 去氢 |
| 加氢 |
| 被氧气氧化 |
| 催化剂 |
| A、A是乙炔,B是乙烯 |
| B、A是乙醇,B是乙醛 |
| C、A是乙烯,B是乙烷 |
| D、A是环己烷,B是苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com