
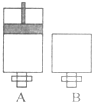
 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.| 消耗量 |
| 起始量 |
| 0.8mol×32g/mol+1.6mol×64g/mol |
| V |
| 0.48mol |
| 0.8mol |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积 | 所消耗演算标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素或原子 | 元素的性质或原子的结构的描述 |
| Ⅰ | 原子核内只有一个质子 |
| Ⅱ | 最外层电子数是次外层的2倍 |
| Ⅲ | 地壳中含量最多的元素 |
| Ⅳ | 原子失去一个电子后为单核10电子的阳离子 |
| Ⅴ | 原子得到一个电子后,与氩原子的电子层结构相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
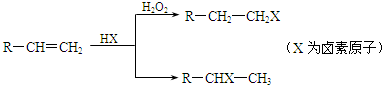
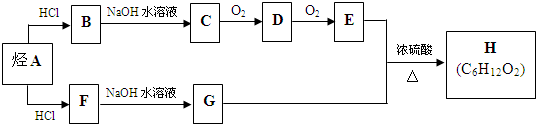
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②③ | C、③⑤ | D、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
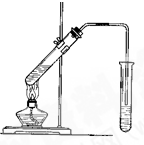 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
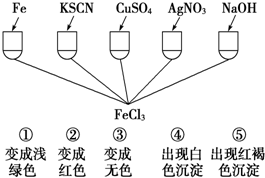 阅读下列材料后,回答相应问题.
阅读下列材料后,回答相应问题.| A |
| B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com