
 阅读下列材料后,回答相应问题.
阅读下列材料后,回答相应问题.| A |
| B |
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

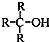 )不能氧化成醛或酮.
)不能氧化成醛或酮.查看答案和解析>>
科目:高中化学 来源: 题型:
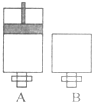 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol?L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| B、T1温度下的平衡常数K1=125(mol?L-1)3,平衡时N2O5的转化率为50% | ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
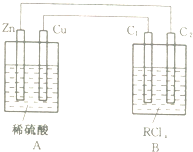 某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.
某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:
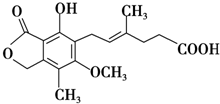
| A、分子式为C17H22O6 |
| B、能与FeCl3溶液发生显色反应,与浓溴水反应最多可消耗2molBr2 |
| C、1 mol麦考酚酸最多能与3 mol NaOH反应 |
| D、在一定条件下可发生加成、加聚、取代、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 氢氧化钠 碳酸钠 硫酸铜 |
| B、盐酸 硝酸银 氯化钠 硝酸钠 |
| C、氢氧化钠 硫酸镁 氯化钠 盐酸 |
| D、氯化钡 硫酸钠 氯化钙 硝酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、将含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:

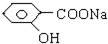
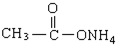
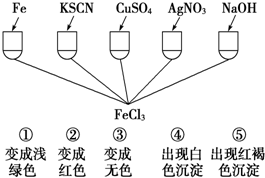
| A、全部 | B、仅①②③④ |
| C、仅①④⑤ | D、仅①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com