

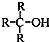 )不能氧化成醛或酮.
)不能氧化成醛或酮.| 92.5×9.73% |
| 1 |
| 92.5-35.5-9 |
| 12 |
| 92.5×9.73% |
| 1 |
| 92.5-35.5-9 |
| 12 |
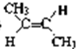 ,名称为反-2-丁烯,故答案为:
,名称为反-2-丁烯,故答案为: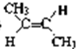 ;反-2-丁烯;
;反-2-丁烯;| △ |
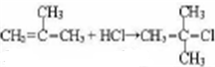 ,
,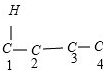 、
、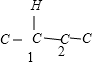 、
、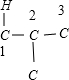 ,故C4H2Cl8共有9种,
,故C4H2Cl8共有9种,| △ |
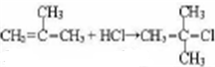 ;9.
;9.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
| B、常温常压下,18 g H2O 中含有的原子总数为3NA |
| C、1 L 0.1 mol?L-1NaHCO3液含有0.1NA个HCO3- |
| D、常温常压下,2.24 L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积 | 所消耗演算标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
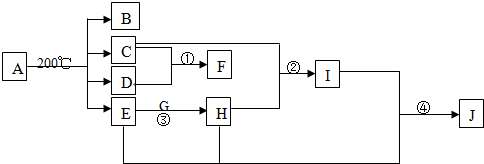
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
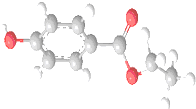 某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢.以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.
某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢.以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.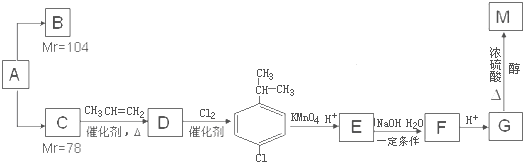
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素或原子 | 元素的性质或原子的结构的描述 |
| Ⅰ | 原子核内只有一个质子 |
| Ⅱ | 最外层电子数是次外层的2倍 |
| Ⅲ | 地壳中含量最多的元素 |
| Ⅳ | 原子失去一个电子后为单核10电子的阳离子 |
| Ⅴ | 原子得到一个电子后,与氩原子的电子层结构相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
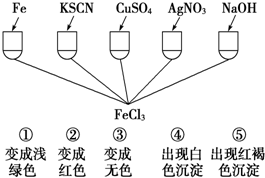 阅读下列材料后,回答相应问题.
阅读下列材料后,回答相应问题.| A |
| B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com