
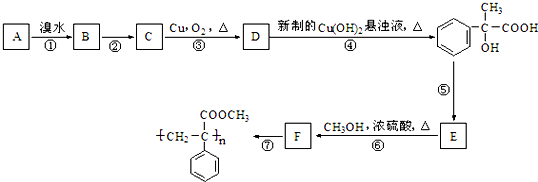
| A、①③⑤ | B、②③ | C、③⑤ | D、③ |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
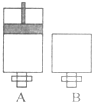 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定有SO42- |
| B | 将SO2通入Ba(ClO)2的溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| C | 将CCl4加入溴水中,振荡、静置 | 溴水褪色 | 发生了取代反应 |
| D | 氯水滴入到KI淀粉溶液中 | 溶液变蓝色 | Cl2具有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol?L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| B、T1温度下的平衡常数K1=125(mol?L-1)3,平衡时N2O5的转化率为50% | ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
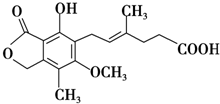
| A、分子式为C17H22O6 |
| B、能与FeCl3溶液发生显色反应,与浓溴水反应最多可消耗2molBr2 |
| C、1 mol麦考酚酸最多能与3 mol NaOH反应 |
| D、在一定条件下可发生加成、加聚、取代、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
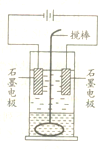 在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com