



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、单质 | B、化合物 |
| C、混合物 | D、氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
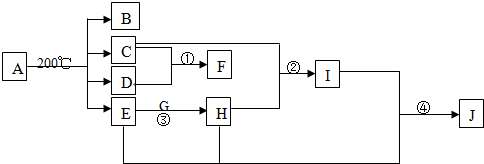
查看答案和解析>>
科目:高中化学 来源: 题型:
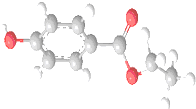 某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢.以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.
某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢.以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.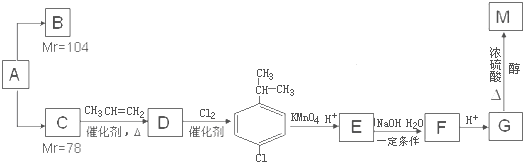
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
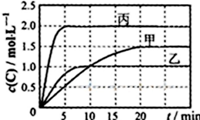 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素或原子 | 元素的性质或原子的结构的描述 |
| Ⅰ | 原子核内只有一个质子 |
| Ⅱ | 最外层电子数是次外层的2倍 |
| Ⅲ | 地壳中含量最多的元素 |
| Ⅳ | 原子失去一个电子后为单核10电子的阳离子 |
| Ⅴ | 原子得到一个电子后,与氩原子的电子层结构相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②③ | C、③⑤ | D、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水可区分苯和溴苯 |
| B、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com