
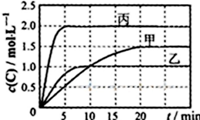
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| △c |
| △t |
| 1mol/L |
| 10min |
| 1 |
| 2 |
| △c |
| △t |
| 1 |
| 2 |
| 1.52 |
| 2.25×0.25 |
| (2x)2 |
| (1-x)(3-x) |
| 0.75 |
| 1 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、单质:水银、石墨、氦气、HD |
| B、氧化物:金刚砂、Na2O2、双氧水、N2O4 |
| C、混合物:水玻璃、盐酸、胆矾、AgI胶体 |
| D、盐:碱式碳酸铜、小苏打、KI,Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
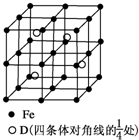 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定有SO42- |
| B | 将SO2通入Ba(ClO)2的溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| C | 将CCl4加入溴水中,振荡、静置 | 溴水褪色 | 发生了取代反应 |
| D | 氯水滴入到KI淀粉溶液中 | 溶液变蓝色 | Cl2具有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com