
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
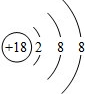 ,
, ;
; ,
, ;离子;
;离子; ,
, ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
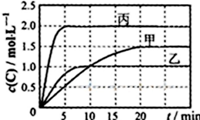 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应量取盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸和Na2CO3溶液 |
| B、稀盐酸和AgNO3溶液 |
| C、AlCl3溶液和NH3?H2O溶液 |
| D、Ba(OH)2溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水可区分苯和溴苯 |
| B、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
| A、萃取法 | B、过滤法 |
| C、分液法 | D、蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物Ⅱ的分子式为
化合物Ⅱ的分子式为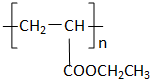 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾和氯水都用于自来水的处理 |
| B、.干冰和碘化银都可用于人工降雨 |
| C、向Fe(OH)3胶体和NaAlO2溶液中逐滴加盐酸,先出现沉淀,然后溶解 |
| D、铁器和铝制容器都可以用来运输浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com