
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量减少 |


科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.4×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A、25℃时五种银盐的饱和溶液中,c(Ag+)最大的是Ag2SO4溶液 |
| B、在氯化银的悬浊液中加入Na2S溶液可以生成黑色的Ag2S |
| C、25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同 |
| D、AgBr沉淀可以转化成AgI沉淀,而 AgI沉淀在一定条件下也可以转化成AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
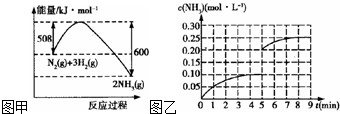
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
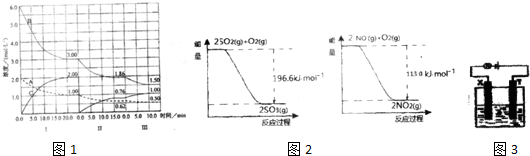
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔离陶瓷属于复合材料 |
| B、CO2和NO2是造成酸雨的主要原因 |
| C、燃煤中加入适量石灰石,可减少废气中SO2的含量 |
| D、垃圾是放错地方的资源,应分类回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com