
| 催化剂 |
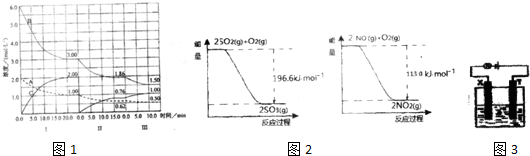
| 催化剂 |
| 催化剂 |
| 1mol/L |
| 2mol/L |
| 1mol/L-0.62mol/L |
| 1mol/L |
| 0.62mol/L-0.5mol/L |
| 0.62mol/L |
 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1, 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,| ①-② |
| 2 |
| -196.6kJ/mol-(-113.0kJ/mol) |
| 2 |
| 0.04mol |
| 2 |
| 0.224L |
| 22.4L/mol |
| ||
| 0.4L |


科目:高中化学 来源: 题型:
| A、用水可区分苯和溴苯 |
| B、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||||
| B、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1 | ||||||
| C、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ?mol-1 | ||||||
| D、N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ca2+、SO42-、Cl- |
| B、H+、Mg2+、CO32-、S2- |
| C、K+、Mg2+、SO42-、NO3- |
| D、K+、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应速率与I-浓度有关 |
| B、IO-也是该反应的催化剂 |
| C、反应活化能等于98kJ?mol-1 |
| D、v(H2O2)=v(H2O)=v(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com