
A、
| ||||||
| B、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1 | ||||||
| C、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ?mol-1 | ||||||
| D、N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ?mol-1 |


科目:高中化学 来源: 题型:
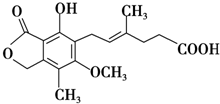
| A、分子式为C17H22O6 |
| B、能与FeCl3溶液发生显色反应,与浓溴水反应最多可消耗2molBr2 |
| C、1 mol麦考酚酸最多能与3 mol NaOH反应 |
| D、在一定条件下可发生加成、加聚、取代、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
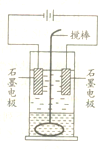 在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.4×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A、25℃时五种银盐的饱和溶液中,c(Ag+)最大的是Ag2SO4溶液 |
| B、在氯化银的悬浊液中加入Na2S溶液可以生成黑色的Ag2S |
| C、25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同 |
| D、AgBr沉淀可以转化成AgI沉淀,而 AgI沉淀在一定条件下也可以转化成AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

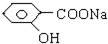
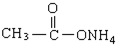
| A、全部 | B、仅①②③④ |
| C、仅①④⑤ | D、仅①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com