
| m |
| M |
| 23g |
| 23g/mol |
| 16g |
| 24g/mol |
| 2 |
| 3 |
| 9g |
| 27g/mol |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O+H2O?H3O++OH- |
| B、HCO3-+H2O?H2CO3+OH- |
| C、HCO3-+H2O?H3O++CO32- |
| D、HCO3-+OH-?H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
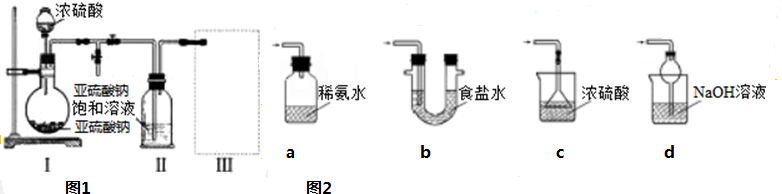

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeI2溶液中滴入过量溴水 2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
| B、Na2O2与H2O反应 2O22-+2H2O=4OH-+O2↑ |
| C、NaHSO4溶液中滴入少量Ba(OH)2 H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol?L-1 |
| B、约有2×10-5mol AgCl溶解 |
| C、反应后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c (H+) |
| D、反应后溶液中的:c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com