
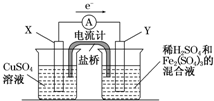
 ��2010?����һģ����2011?�����ʼ죩����ͭ������ϡ���ᣬ������������Һ����ͭ���������Σ��ֽ�һ������ͭƬ���뵽100mLϡ������������Ļ��Һ�У�ͭƬ��ȫ�ܽ⣨�������ε�ˮ�⼰��Һ����ı仯��
��2010?����һģ����2011?�����ʼ죩����ͭ������ϡ���ᣬ������������Һ����ͭ���������Σ��ֽ�һ������ͭƬ���뵽100mLϡ������������Ļ��Һ�У�ͭƬ��ȫ�ܽ⣨�������ε�ˮ�⼰��Һ����ı仯��2- 4 |
| ���������ж� | �缫���� | �缫��Ӧʽ | |
| X�� | �� �� |
ͭ ͭ |
Cu-2e-�TCu2+ Cu-2e-�TCu2+ |
| Y�� | �� �� |
̼ ̼ |
2Fe3++2e-�T2Fe2+ 2Fe3++2e-�T2Fe2+ |
| ���������ж� | �缫���� | �缫��Ӧʽ | |
| X�� | ���� | ͭ | Cu-2e-�TCu2+ |
| Y�� | ���� | ̼ | 2Fe3++2e-�T2Fe2+ |


 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
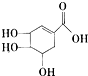 ��2010?����һģ��ç�����Ǻϳ����������кͼ���H7N9����ҩ��--��Ƶ���Ҫԭ�ϣ���֪ç����Ľṹ��ʽ��ͼ��ʾ�����й��������л��������˵����ȷ���ǣ�������
��2010?����һģ��ç�����Ǻϳ����������кͼ���H7N9����ҩ��--��Ƶ���Ҫԭ�ϣ���֪ç����Ľṹ��ʽ��ͼ��ʾ�����й��������л��������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
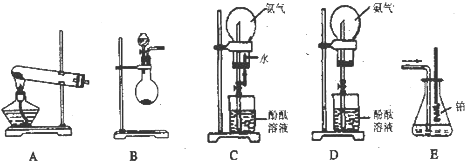
| ||
| ||
| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com