
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 制取少量纯净的CO2 | 验证钠和水的反应时放热反应 | 进行喷泉实验 | 进行中和热的测定 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5(也可写为:NH4H),它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )
A.它与水反应的化学方程式为NH5 + H2O ═ NH3H2O + H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为 
D.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
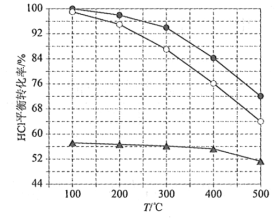
可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
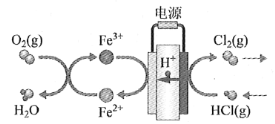
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表情包、斗图是新媒体时代的产物,微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列有关说法正确的是( )

A. A 物质与 D 物质互为同系物
B. 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
C. B 物质是由的1mol 苯与3mol 氯气在光照的条件下发生取代反应而制备得到的
D. C 物质是苯的同系物,其二溴代物有7 种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,用相应的化学用语回答下列问题;
① | |||||||
② | ③ | ④ | ⑤ | ||||
⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中用序号标出的10种元素中,非金属性最强元素的离子结构示意图是____________。
(2)④、⑦、⑩的离子半径由大到小的顺序为____________(用元素符号作答)。
(3)由表中④、⑥元素可以组成一种淡黄色的物质,画出该物质的电子式____________,该物质含有的化学键类型有____________。
(4)元素②的简单气态氢化物为X,0.1molX完成燃烧生成稳定氧化物时放出akJ的能量,写出X燃烧热的热化学方程式:____________。
(5)写出实验室制备氨气的反应方程式____________。
(6)一种氢气燃料电池的原理如图:
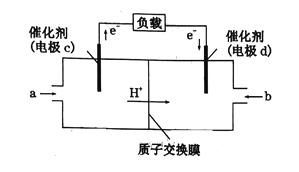
a极通入的气体是____________,正极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】幸福可以“人工合成”吗?精神病学专家通过实验发现,人体中的一种脑内分泌物多巴胺,可影响一个人的情绪。多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐。多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
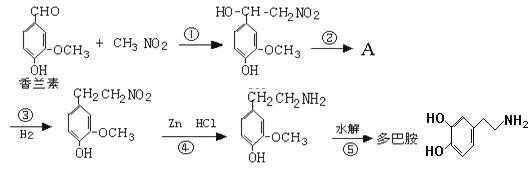
请回答下列问题:
(1)写出香兰素中含有的官能团的名称是___________________。
(2)上述合成过程中属于加成反应的是 (填反应序号)_____________。
(3)反应②的反应条件是__________。有机物A的结构简式为____________。
(4)写出符合下列条件的多巴胺的所有同分异构体的结构简式:_______________。
(i)属于1,3,5-三取代苯 (ii)苯环上直接连有一个羟基和一个氨基
(iii)分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2∶1
(5)多巴胺遇足量浓溴水会产生沉淀,请写出该反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物多为重要的化工原料。请回答下列问题:
I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。
(1)Na2S2的电子式为___。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。
II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。
(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为___。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为___。
III.硫代硫酸钠(Na2S2O3)是一种重要的滴定试剂,常用来滴定溶液中的含碘量。
(7)为测定某碘水中I2的浓度(假设碘水中的碘元素均以碘单质形式存在),取该碘水200.00mL,加入淀粉溶液作为指示剂,滴加0.01mol·L-1硫代硫酸钠标准液,发生反应:I2+2S2O32-=S4O62-+2I-,当___(填实验现象),即为终点。平行滴定3次,标准液的平均用量为20.00mL,则该碘水中I2的浓度为___mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com