
【题目】氮的氧化物处理和利用是环境科学研究的热点。
Ⅰ.碱吸法。用烧碱溶液吸收NO、NO2制备亚硝酸盐:2NaOH+NO2+NO=2NaNO2+H2O,2NO2+2NaOH= NaNO3+NaNO2+H2O。已知:298K时,Ka(HNO2)=5×10-4。
(1)298K时,NaNO2的水解常数约为______________。
Ⅱ.电解法。工业上以石墨为电极,用硝酸铵稀溶液作电解质溶液电解NO获得氮肥(在电解后溶液中通入适量氨气),其原理为8NO+7H2O+2NH3![]() 5NH4NO3。
5NH4NO3。
(2)阴极的电极反应式为_______________。
(3)阳极区电解质溶液的pH________(填“增大”“减小”或“不变”)。
Ⅲ.化合法。亚硝酸酰氯(NOCl)是有机合成中的重要试剂,可用NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2NOCl(g)。
2NOCl(g)。
(4)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
△H1、△H2、△H3之间的关系为_____________;K3=________(用含K1、K2的关系式表示)。
(5)在2L恒容容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(NOCl)与时间(t)的关系如图所示。

①T2时反应0~10min内NOCl的平均反应速率v(NOCl)=______mol·L-1·min-1。
②T2时反应的平衡常数K为__________;NO的平衡转化率α(NO)为_________。
③T2时向上述平衡体系中再加入1molNO(g)、1molCl2(g)、2molNOCl(g),则平衡______(填“向左”“向右”或“不”)移动。
(6)在密闭容器中充入NO(g)和Cl2(g),改变外界条件,Cl2的转化率变化如图所示。则该条件可能为____(填字母)。

A.升高温度 B.增大压强 C.增大起始投料比![]() D.增大催化剂接触面
D.增大催化剂接触面
【答案】 2.0×10-11 NO+6H++5e-=NH4++H2O 减小 △H3=2△H1-△H2 K3=K12/K2 0.05 1/6.75 25% 向左 B
【解析】已知:298K时,Ka(HNO2)=5×10-4。
(1)298K时,NaNO2的水解的离子方程式为NO2-+H2O ![]() HNO2+OH-常数约为
HNO2+OH-常数约为 =
= =
= ![]()
![]() Kw =
Kw = ![]()
![]() =2.0×10-11
=2.0×10-11
(2)阴极发生还原反应,电极反应式为NO+6H++5e-=NH4++H2O .
(3)阳极发生氧化反应,水电离的氢氧根放电,电极反应式为2H2O-4e-=O2↑+4H+,所以电解质溶液的pH减小。
(4)分析表中三个反应之间的关系,发现③=①![]() 2-②,所以△H1、△H2、△H3之间的关系为△H3=2△H1-△H2 ;
2-②,所以△H1、△H2、△H3之间的关系为△H3=2△H1-△H2 ;
K3= =
= 
![]()
 =K12/K2 。
=K12/K2 。
(5)在2L恒容容器中充入4molNO(g)和2molCl2(g):
2NO(g)+ Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
起始量(mol/L) 2 1 0
T2变化量(mol/L) 0.5 0.25 0.5
T2平衡量(mol/L) 1.5 0.75 0.5
①T2时反应0~10min内NOCl的平均反应速率
v(NOCl)= ![]() = 0.05mol·L-1·min-1。
= 0.05mol·L-1·min-1。
②T2时反应的平衡常数K= =
= ![]() = 1/6.75;NO的平衡转化率α(NO)=
= 1/6.75;NO的平衡转化率α(NO)= ![]()
![]() 100%=25%。
100%=25%。
③T2时向上述平衡体系中再加入1molNO(g)、1molCl2(g)、2molNOCl(g),求出此时Qc=![]() span> =0.45>1/6.75,所以则平衡向左移动。
span> =0.45>1/6.75,所以则平衡向左移动。
(6)由上面图像可知,T2先达平衡,所以T2>T1,升高温度后生成物NOCl的平衡浓度减小,所以正反应是气体体积减小的放热反应。在密闭容器中充入NO(g)和Cl2(g),改变外界条件,Cl2的转化率随横坐标的增大而增大,说明改变的条件有利于正反应的发生,这个条件只能选B增大压强。因为升高温度平衡向逆反应方向移动,C增大投料比,氯气的转化率将减小,D增大催化剂的接触面能同等程度增大正、逆反应的速率,但是平衡不发生移动。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关。下列说法错误的是
A. 晶体硅是良好的半导体材料,用于制作光导纤维
B. 新型净水剂的制备和应用,进一步提高了饮用水的质量
C. 过氧化钠可用作为制氧剂
D. 深海底层“可燃冰”的试采成功,为其使用开拓了广阔前景
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。
已知:① 2R-COOH + 2Na → 2R-COONa + H2↑
② R-COOH + NaHCO3→ R-COONa + CO2↑ + H2O
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
|
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团 |
(4)A的核磁共振氢谱如下图: |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g) ![]() CH3OH(g) △H = —91kJ/mol。
CH3OH(g) △H = —91kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —580kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —570kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H = ________________。
若在恒温恒容的容器内进行反应CO(g)+2H2(g) ![]() CH3OH(g),下列表示该反应没有达到平衡状态的有________(填字母序号)。
CH3OH(g),下列表示该反应没有达到平衡状态的有________(填字母序号)。
A.CO百分含量保持不变 B.容器中混合气体的密度不变化
C.有1个H—H键生成的同时有 3个C—H键生成 D.容器中混合气体的压强不变化
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g) ![]() H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O) 若起始时c(CO)=1mol/L-1,c(H2O)=1mol/L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O) 若起始时c(CO)=1mol/L-1,c(H2O)=1mol/L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol/L-1,则此时该反应v(正)__________v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为________。
(3)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。
①试想该电池工作时,OH— 向_______极移动(填“负”或“正”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为______________________。总反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol·L-1Q溶液是AG(酸度)=lg =-12,由M和Y组成的化合物MY是强电解质。下列说法正确的是
=-12,由M和Y组成的化合物MY是强电解质。下列说法正确的是
A. 简单离子半径:Y>R>X B. Y的氧化物对应的水化物一定是强酸
C. X分别与M、R、Y组成的二元化合物中都只含离子键 D. 化合物XRM和XYR均能抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说正确的是( )
A.物质的量就是1摩尔物质的质量
B.1 mol水中含有2 mol氢和1 mol氧
C.1 molH2中含有6.02个氢分子
D.CO2的摩尔质量是44 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是合成植物生长调节剂赤霉酸的重要中间体,其合成路线如下:

已知:A与FeCl3溶液发生显色反应。
(1)A的结构简式为________,J的分子式为___________________。
(2)化合物Ⅰ的含氧管能团名称为______________。
(3)C→D的反应类型是_____________, E→F的反应类型是_________________。
(4)写出B与CuO反应的化学方程式:_________________________。
(5)同时满足下列条件的F的同分异构体共有________种,写出其中核磁共振其氢谱中有7 组吸收峰的结构简式:________。
I.分子中含有![]() 结构
结构
II.能与NaHCO3溶液反应产生CO2
(6)根据已有知识并结合相关信息,写出以![]() 为有机原料制备
为有机原料制备![]() 的合成路线流程图(无机试剂任选,可选择适当有机溶剂)。________合成路线流程示例如下:
的合成路线流程图(无机试剂任选,可选择适当有机溶剂)。________合成路线流程示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I构建和谐社会,建设社会主义新农村的目标之一是让农民饮用清洁的自来水。ClO2是新一代饮用水的消毒剂,许多发达国家采用ClO2代替C12进行自来水的消毒。请回答下列问题:
(1)消毒时单位质量的氧化剂得到电子的物质的量,叫其消毒效率, 已知ClO2、Cl2作消毒剂时均变为Cl—,则ClO2的消毒效率是Cl2的_________倍。
(2)制取ClO2的微观过程如图所示:

![]()
![]()
![]() (其中:
(其中: ![]() 表示钠原子,
表示钠原子, ![]() 表示氯原子,
表示氯原子, ![]() 表示氧原子)
表示氧原子)
该反应的化学方程式是 ___________________________________________________。
II. 德国化学家格哈德·埃特尔在固体表面化学的研究中取得了非凡的成就,其成果之一是揭示了氮气与氢气在催化剂表面合成氨的反应过程(下图所示)。其反应方程式为
“N2 + 3H2![]() 2NH3”,符合上述反应过程的顺序是_______.
2NH3”,符合上述反应过程的顺序是_______.
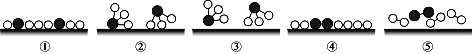
A.⑤④①③② B. ④⑤①②③ C. ④⑤①③② D. ⑤④①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com