
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是
| A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14 |
| B.0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 |
| C.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 |
| D.某温度下,AB难溶性离子化合物的Ksp=1.0×10-10, 其饱和溶液中pC(A+) +pC((B-)=10 |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:单选题
常温下,用 0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L
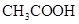 溶液所得滴定曲线如右图。下列说法正确的是
溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: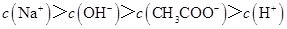 |
D.滴定过程中可能出现: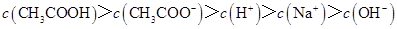 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s)=2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是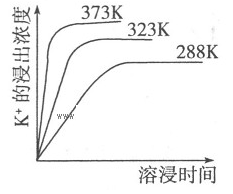
| A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) |
| D.升高温度,反应速率增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是
| A.氨水的浓度等于盐酸的浓度 |
| B.原氨水中有1%的含氮微粒为NH4+ |
| C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:

 ,下列说法正确的是( )
,下列说法正确的是( )
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NaHA是二元酸H2A的酸式盐,下列说法不正确的是 ( )
| A.若NaHA溶液呈酸性,则H2A一定是强酸 |
| B.若NaHA溶液呈碱性,则H2A一定是弱酸 |
| C.NaHA溶液中Na+和HA-的个数之比一定大于1∶1 |
| D.NaHA晶体中的阴阳离子个数比一定是1∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为探究某种盐的水解是吸热反应。有四位同学分别设计了如下实验方案:
| 同学 | 实验设计 |
| 甲 | 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 |
| 乙 | 加热能使溶液中的Fe3+转化成Fe(OH)3沉淀,说明Fe3+水解是吸热的 |
| 丙 | 通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸钠水解是吸热的 |
| 丁 | 在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com