
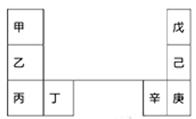
甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断不正确的是
A.与水反应的剧烈程度:甲>乙>丁
B.气态氢化物的沸点:戊<己<庚
C.丙和庚的核外电子数相差15
D.乙单质在空气中燃烧生成含共价键的离子化合物
 |
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+ 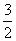 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=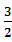 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
H2S(g)+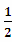 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
2S(g) =S2(g) △H4
则△H4的正确表达式为
A.△H4=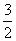 (△H1+△H2-3△H3) B.△H4=
(△H1+△H2-3△H3) B.△H4=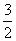 (3△H3-△H1-△H2)
(3△H3-△H1-△H2)
C.△H4=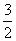 (△H1+△H2+3△H3) D.△H4=
(△H1+△H2+3△H3) D.△H4=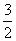 (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下:
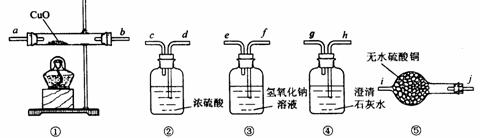
(1)实验时,连接装置的顺序是 ;导管接口的顺序是
(2)装 置①内发生反应的化学方程式是
置①内发生反应的化学方程式是
(3)证明混合气体中含有氢气的实验现象是
(4)证明混合气体中含有CO的实验现象是
(5)装置②的作用是 ;装置④的作用是 
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标况下,11.2L SO3所含的分子数目为0.5 NA
B.室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA
C.铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA
D.8 Al + 3 NH4ClO4 == 4 Al2O3 +3NH3 +3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量—27)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,以下说法不正确的是
A.CaO能与SO2反应,可作燃煤的脱硫剂
B.食醋可用于除去暖水瓶中的水垢
C.明矾水解时产生具有吸附性的胶体粒子,可作净水剂
D.铁在空气中易形成致密的氧化膜,可用来运输浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.48gO3气体含有6.02×1023个O3分子
B.5.6g Fe与足量的稀盐酸反应转移电子0.3 mol
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×102 3个H2O分子
3个H2O分子
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硫酸生产流程如下图:
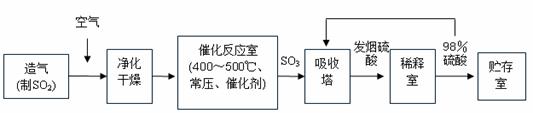
已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为
A.净化气体  B.控制温度在400~500℃
B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变 为97.2L,则SO2的转化率为
为97.2L,则SO2的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.NH3 分子比PH3 分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com