
有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下:
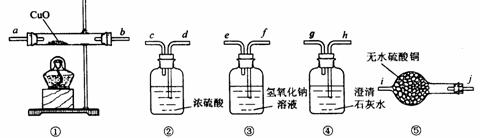
(1)实验时,连接装置的顺序是 ;导管接口的顺序是
(2)装 置①内发生反应的化学方程式是
置①内发生反应的化学方程式是
(3)证明混合气体中含有氢气的实验现象是
(4)证明混合气体中含有CO的实验现象是
(5)装置②的作用是 ;装置④的作用是 
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液,CO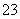 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列烷烃在光照下与氯气反应,只生成一种一氯代物的是 ( )
A.CH3CH2CH2CH3 B.CH3CH(CH3)2
C.CH3C(CH3)3 D.(CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
A.分子式为C7H6O5
B.分子中含有两种官能团
C.可发生加成和取代反应
D.分子中有7个碳原子共平面
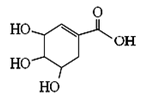
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断不正确的是
A.与水反应的剧烈程度:甲>乙>丁
B.气态氢化物的沸点:戊<己<庚
C.丙和庚的核外电子数相差15
D.乙单质在空气中燃烧生成含共价键的离子化合物
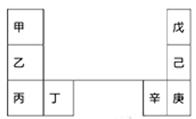 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在溶液中一定能大量共存的是
A.pH=12的溶液:K+、Na+、CH3COO—、CO32—
B.与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3—、NO3—
C.由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ca2+、SO32—、Cl—
D.0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
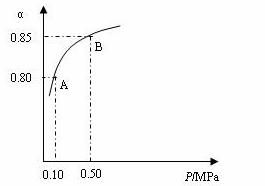
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
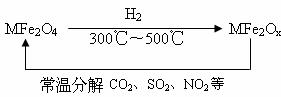
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com