
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
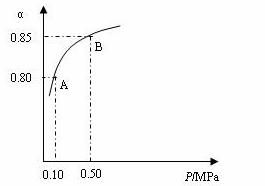
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
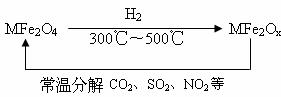
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
【答案】
(1)①800L·mol-1
② =
(2)1.60NA(或1.6NA)
173.4
(3)MFe2Ox+SO2→MFe2O4+S
【解析】本题考查有关化学平衡的概念、计算、有关反应热的计算及氧化还原知识。由图象中的数据可计算平衡常数;(2)中计算是有关电子转移数目的计算。
(1)0.10 MPa时:c(SO2)=2 mol×(1-0.8)×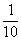 =0.04 mol·L-1
=0.04 mol·L-1
c(O2)=(1 mol-1.6 mol×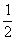 )×
)×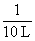 =0.02 mol·L-1
=0.02 mol·L-1
c(SO3)=1.6 mol×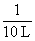 =0.16 mol·L-1
=0.16 mol·L-1
K=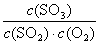 =
=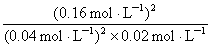 =800 L·mol-1
=800 L·mol-1
②由A到B,温度不变,只增大压强,K不变。
(2)本小题是有关氧化还原和反应热的计算,由 盖斯定律把两式相加,得2CH4(g)+4NO2(g)===2N2(g)+2CO2(g)+4H2O(g) ΔH=-1734 kJ·mol-1
盖斯定律把两式相加,得2CH4(g)+4NO2(g)===2N2(g)+2CO2(g)+4H2O(g) ΔH=-1734 kJ·mol-1
转移电子数: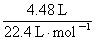 ×8=1.6 mol,故为1.6NA
×8=1.6 mol,故为1.6NA
放出热量:0.2 mol×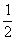 ×1 734 kJ·mol-1=173.4 kJ
×1 734 kJ·mol-1=173.4 kJ
(3)由于信息转化关系已确定,只要确定被分解物质的产物即可写出反应方程式。分解SO2由条件可推出SO2作氧化剂,只有还原为单质硫时才防止污染环境。


科目:高中化学 来源: 题型:
有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下:
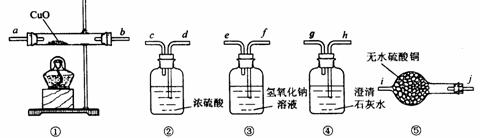
(1)实验时,连接装置的顺序是 ;导管接口的顺序是
(2)装 置①内发生反应的化学方程式是
置①内发生反应的化学方程式是
(3)证明混合气体中含有氢气的实验现象是
(4)证明混合气体中含有CO的实验现象是
(5)装置②的作用是 ;装置④的作用是 
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硫酸生产流程如下图:
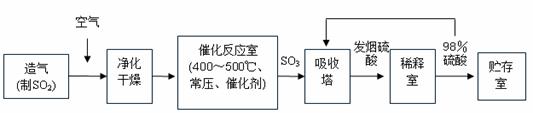
已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为
A.净化气体  B.控制温度在400~500℃
B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变 为97.2L,则SO2的转化率为
为97.2L,则SO2的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
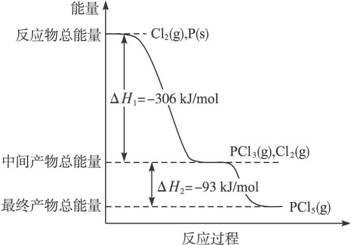
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程 式是
式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2 α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________
(4)P和Cl2分两步反应生成1mol PCl5的△H3=____________,P和Cl2一步反应生成1molPCl5的△H4__________△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
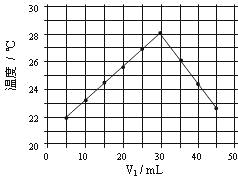
A 做该实验时环境温度为22℃
B 该实验表明化学能可能转化为热能
C NaOH溶液的浓度约为1.0mol/L
D 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
⑴ 比较下列两组物质的熔点高低(填>或<)
SiC______ Si; SiCl4 ______ SiO2
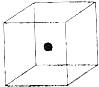
⑵ 图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) + 4HCl(g)
Si(s) + 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.NH3 分子比PH3 分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
A.X:3s23p2 Y:3s23p5 B.X:2s22p3 Y:1s1
C.X:3s2 Y:2s22p5 D.X:2s22p3 Y:2s22p4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com